Comprender cómo se propagan las células cancerosas desde un tumor primario es importante por diversas razones, incluida la determinación de la agresividad de la enfermedad en sí. El movimiento de las células hacia la matriz extracelular (MEC) del tejido vecino es un paso esencial en la progresión del cáncer que se correlaciona directamente con la aparición de metástasis.
En un estudio publicado en APL Bioengineering Un equipo de investigadores de Alemania y España utilizó un panel de líneas celulares de cáncer de mama y explantes de tumores primarios de pacientes con cáncer de mama y de cuello uterino para examinar dos modos diferentes de contractilidad celular:uno que genera tensión superficial colectiva del tejido que mantiene compactos los grupos de células y otro, más direccional. , contractilidad que permite a las células introducirse en la ECM.
"Nos centramos en dos parámetros:la capacidad de las células para tirar de las fibras de la ECM y generar fuerzas de tracción y su capacidad para tirar entre sí, generando así una alta tensión superficial del tejido", dijo la autora Eliane Blauth. "Vinculamos cada propiedad a diferentes mecanismos contráctiles y preguntamos cómo se relacionan con el escape de las células cancerosas y la agresividad del tumor".
El equipo descubrió que las células más agresivas tiran con más fuerza de la MEC que de sí mismas, mientras que las células no invasivas tiran más de sí mismas que de la MEC, y que los diferentes comportamientos de tracción se atribuyen a diferentes estructuras del citoesqueleto de actina dentro de las células.
Las células invasivas utilizan predominantemente fibras de estrés de actina (haces gruesos de actina que abarcan la célula) para generar fuerzas en su entorno, mientras que las células no invasivas generan fuerzas a través de su corteza de actina, una red delgada directamente debajo de la membrana celular.
El estudio demostró que no es la magnitud general de estos modos de contractilidad sino la interacción entre ellos lo que determina el potencial de escape de una célula. Los experimentos con células moderadamente invasivas demostraron que la fuerza total que estas células generan en las fibras de la MEC es comparable a la de las células no invasivas; sin embargo, aún pueden desprenderse e invadir la MEC, lo que no es posible para las células no invasivas.
"Las células no invasivas todavía tienen una alta contractilidad cortical, lo que las mantiene unidas, mientras que las células moderadamente invasivas tienen una contractilidad cortical que casi desaparece", dijo Blauth. "Así que no hay mucho que los frene a pesar de que tiran mucho más débilmente de las fibras del ECM".
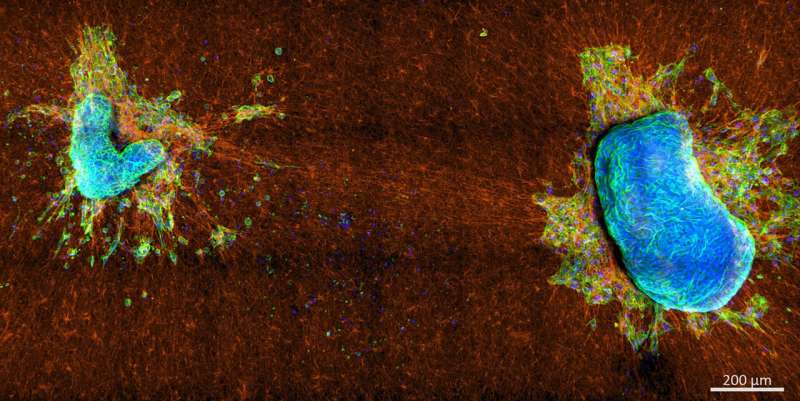
Las mediciones del equipo con explantes de tumores vitales obtenidos de pacientes confirmaron sus hallazgos de los experimentos con líneas celulares. En este caso, el número de células con una alta contractilidad cortical disminuyó durante la progresión del tumor.
"Esto indica además que la capacidad de las células para unirse entre sí y mantenerse agrupadas se debilita a medida que el tumor crece, lo que potencialmente aumenta el riesgo de metástasis".
Más información: Diferentes modos de contractilidad controlan el escape celular de esferoides multicelulares y explantes tumorales, APL Bioengineering (2024). DOI:10.1063/5.0188186
Información de la revista: Bioingeniería APL
Proporcionado por el Instituto Americano de Física