Desde su descubrimiento, los investigadores han demostrado repetidamente las posibles aplicaciones médicas de células y tejidos diferenciados generados a partir de células madre pluripotentes inducidas (iPS). Sin embargo, un obstáculo importante para las aplicaciones médicas en el mundo real está relacionado con el sustrato utilizado para cultivar e inducir células iPS en tipos de células diferenciadas.
En particular, si bien se han informado protocolos de diferenciación que generan miocitos y células madre musculares (MuSC) a partir de células iPS, su eficiencia sigue siendo relativamente baja y requieren el uso de un sustrato popular de origen animal llamado Matrigel.
En el futuro, son necesarios protocolos de inducción más eficientes y un cambio hacia sustratos libres de xenos (sin productos de origen animal) capaces de garantizar la rentabilidad, la reproducibilidad y la seguridad.
Con este fin, un equipo colaborativo de Japón ha combinado su experiencia para diseñar y validar una nueva proteína de matriz extracelular recombinante, denominada fragmentos de laminina de nueva generación (NGLF), para diferenciar células iPS en linajes de células musculares.
Los resultados de este estudio fueron publicados en Advanced Science el 29 de abril de 2024.
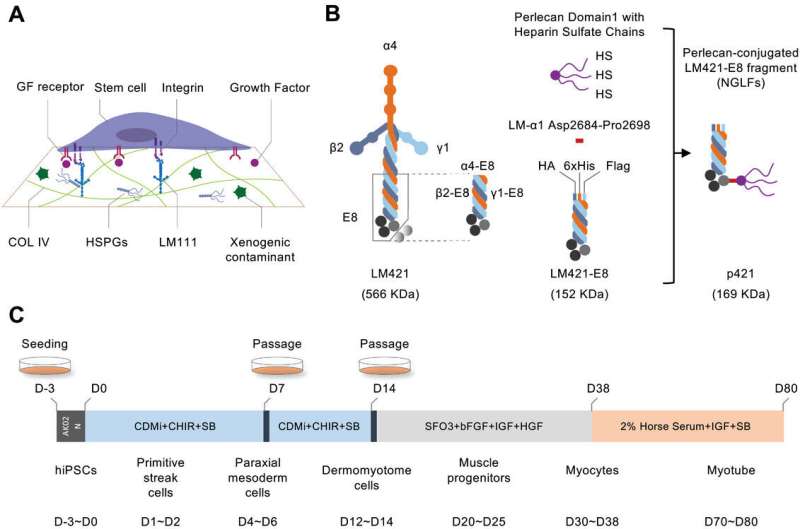
Estudios anteriores han establecido fragmentos de laminina E8 recombinante (LM-E8) como sustrato mínimo para cultivos de células iPS, pero no respaldan la diferenciación miogénica. Para identificar una variante de LM-E8 capaz de soportar la generación de miocitos y MuSC a partir de células iPS, el equipo probó varias lamininas con diferentes composiciones, pero descubrió que solo soportaban niveles drásticamente más bajos de diferenciación miogénica.
Los investigadores razonaron que el perlecano, un núcleo de proteoglicano de heparán sulfato multifuncional (HSPG) con múltiples cadenas de heparán sulfato en Matrigel, puede ser vital para su capacidad de soportar diversas interacciones moleculares necesarias para el mantenimiento y la diferenciación óptimos de las células iPS y, por lo tanto, diseñaron un LM-E8 adjunto al dominio perlecano 1 con tres cadenas HS (D1-HS).
Los investigadores observaron mejoras significativas en la diferenciación miogénica al adjuntar esta modificación a los extremos C de las variantes LM-E8. En particular, la isoforma p421 mostró la mejor mejora, incluso mejor que Matrigel, por lo que los investigadores se centraron en utilizar esta isoforma para generar miocitos y MuSC.
Al examinar los marcadores de diferenciación en varias etapas (es decir, raya primitiva (PS), mesodermo paraxial (PM) y dermomiotoma (DM)), el equipo de investigación confirmó que no solo los NGLF son superiores a las variantes LM-E8 correspondientes en la promoción de etapas específicas. expresión del gen marcador, p421 respalda consistentemente una mejor diferenciación que cualquier otro NGLF probado.
En particular, los investigadores encontraron que p421 apoya específicamente la diferenciación a la etapa PM, ya que no se observaron efectos beneficiosos de p421 después de la formación de PM. Además, utilizando heparitinasa (para degradar las cadenas HS) y surfen (para inhibir las interacciones mediadas por HS), dedujeron que los efectos beneficiosos de p421 se derivan principalmente del resto HS.
Además, al bloquear múltiples receptores de señalización y sus efectores intracelulares posteriores, determinaron que p421 funciona principalmente a través de la vía bFGF-FGFR-EGF para promover la inducción de PM. El análisis de la expresión genética indicó además que esta señalización apoyaba la expresión del gen HOX para promover células iPS indiferenciadas hacia la etapa PS.
Para demostrar la importancia de la orientación de la conjugación entre LM-E8 y D1-HS, los investigadores generaron variantes de p421 uniendo el resto HS al extremo N-terminal de la cadena β o γ de LM-E8. Aunque estas variantes aumentaron la expresión del gen marcador específico de la etapa, p421 mostró efectos sustancialmente más fuertes en comparación.
A partir de estos hallazgos, el equipo de investigación concluyó que p421 probablemente ayuda a la señalización del FGFR al acercar los FGF unidos a HS a la superficie celular para promover la dimerización del FGFR.
Finalmente, para ilustrar cómo p421 mejora la diferenciación miogénica y supera las inconsistencias que plagan los protocolos de inducción actuales, el equipo de investigación generó líneas celulares iPS de enfermedad y control para dos formas de distrofia muscular, la distrofia muscular de Duchene (DMD) y la miopatía de Miyoshi (MM).
Como se esperaba, p421 apoyó una diferenciación miogénica muy mejorada de todas las líneas celulares iPS examinadas. Además, los investigadores descubrieron que p421 mejoraba la diferenciación miogénica en varios medios de cultivo de uso común.
En resumen, el equipo de investigación creó con éxito un sustrato de proteoglicano recombinante que respalda mejoras significativas en la diferenciación miogénica y demostró su mecanismo subyacente.
Se espera que los NGLF ayuden a establecer protocolos de diferenciación altamente eficientes y libres de xenos para generar linajes de células musculares derivadas de células iPS para aplicaciones médicas contra diversas miopatías.
Más información: Mingming Zhao et al, fragmentos de laminina-E8 conjugada con cadena de sulfato de heparán avanzan la diferenciación mesodérmica paraxial seguida de una alta inducción miógena a partir de hiPSC, Ciencia avanzada (2024). DOI:10.1002/adv.202308306
Información de la revista: Ciencia avanzada
Proporcionado por la Universidad de Kyoto