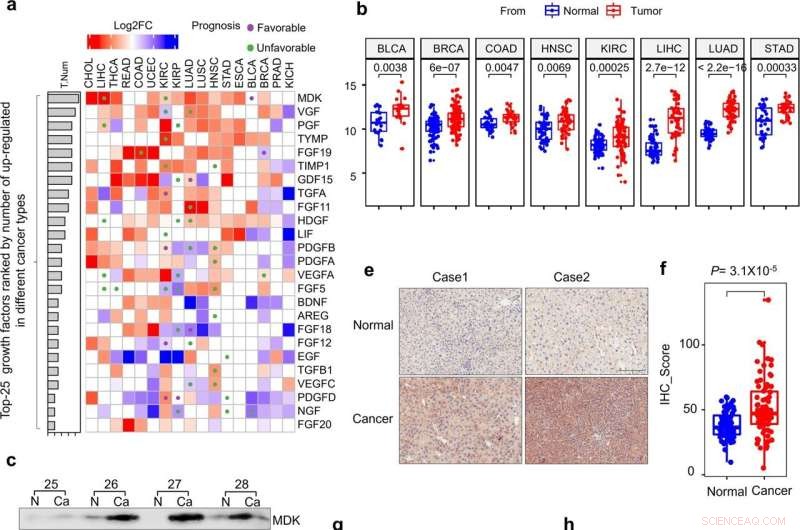
La expresión de midquinas está regulada positivamente en el cáncer. una evaluación Pan-cáncer de la expresión y el impacto pronóstico de los factores de crecimiento. El color de cada rectángulo representa el cambio de pliegue transformado log2 (Log2FC) de la expresión del ARNm para el factor de crecimiento correspondiente entre el tumor y los tejidos normales, y los rectángulos blancos indican un valor de Log2FC igual a 0 o diferencias entre el tumor y los tejidos normales que no son significativo (enfoque del modelo lineal de limma, P > 0.01). Los círculos morados y verdes representan una alta expresión génica correlacionada con un buen y un mal pronóstico, respectivamente (prueba de rango logarítmico, P < 0,01). Las barras de la izquierda representan el número de tipos de cáncer en los que un factor de crecimiento está regulado al alza en los tejidos tumorales en comparación con los tejidos normales (P < 0.01, log2FC > 1). Los factores de crecimiento están ordenados por números y solo se muestran los 25 factores principales. b Diagramas de caja de las diferencias en la expresión de MDK en tejidos normales y tumorales emparejados de ocho tipos de cáncer. Los centros de las cajas representan los valores medianos. Los límites inferior y superior de las cajas representan los percentiles 25 y 75, respectivamente. Los bigotes indican 1,5 veces el rango intercuartílico. Los puntos representan puntos que quedan fuera de este rango. Los valores de P emparejados se calcularon en base a las pruebas de Wilcox. c–d La expresión de MDK en 36 pares de tejidos no tumorales (NT) y cancerosos (Ca) adyacentes emparejados según lo detectado por transferencia Western (c), y la distribución de la expresión de MDK en las muestras de NT y Ca según lo representado por diagramas de caja con el valor de expresión normalizado por el software ImageJ (d). e–f Tinción inmunohistoquímica de MDK en muestras no tumorales adyacentes representativas y muestras de HCC (e) y diagramas de caja de las distribuciones del estado de expresión de MDK en 75 tejidos incluidos en parafina emparejados (f). Barra de escala, 200 μm. g-h Curvas de supervivencia de Kaplan-Meier de pacientes LIHC (g) y KIRC (h) con datos estratificados por los niveles de expresión obtenidos de la base de datos TCGA. Crédito:Muerte celular y enfermedad (2022). DOI:10.1038/s41419-022-04801-0
Un grupo de investigación dirigido por el Prof. Piao Hailong del Instituto de Física Química de Dalian (DICP) de la Academia de Ciencias de China (CAS) descubrió una nueva función del factor de crecimiento Midkine para suprimir la quinasa hepática B1 / Proteína quinasa activada por AMP (LKB1 -AMPK) de forma intracelular no canónica.
Descubrieron que al interrumpir el complejo LKB1-STRAD-Mo25 (STRAD:adaptador de quinasa relacionado con STE20), Midkine disminuyó la actividad de LKB1 y atenuó la fosforilación de AMPK para promover la proliferación de células cancerosas y la progresión del tumor.
Este estudio fue publicado en Muerte celular y enfermedad el 29 de abril.
Midkine pertenece a la familia de los factores de crecimiento de las pleiotrofinas y participa en diversos procesos fisiológicos. La expresión de Midkine aumenta en diferentes tipos de tumores malignos humanos.
Al igual que otros factores de crecimiento, Midkine se secreta al espacio extracelular después de la escisión del péptido señal. Por lo general, la Midkina secretada se considera un ligando que se une a diferentes receptores transmembrana para inducir la señalización intracelular.
Aunque algunos estudios han informado que la Midkine secretada se puede transportar de regreso a las células a través de la endocitosis, aún no está claro si la Midkine intracelular realiza funciones biológicas.
En este estudio, los investigadores encontraron que la relocalización de Midkine fue altamente eficiente y que Midkine internalizado se detectó principalmente en el citoplasma, lo que indica alguna función intracelular no informada de Midkine.
Los investigadores se centraron en la señalización de AMPK y descubrieron que Midkine suprimía la fosforilación de AMPK en el sitio Thr172 de la subunidad α. Esto resultó en la inactivación de AMPK de una manera dependiente intracelular, y cuando la heparina detuvo a Midkine en el espacio extracelular, se alivió la represión de Midkine a AMPK.
Además, encontraron que Midkine suprimió la activación de AMPK a través de la quinasa LKB1 aguas arriba. El análisis de espectrometría de masas (MS) combinado con la prueba de inmunoprecipitación demostró que Midkine se asoció con LKB1 y STRAD para interrumpir el complejo LKB1-STRAD-Mo25, que era indispensable para la activación de LKB1.
Mediante la ingeniería de la expresión de Midkine y LKB1, los investigadores verificaron que Midkine promovía la proliferación de células cancerosas a través del eje LKB1-AMPK. El análisis de los datos clínicos también confirmó que la expresión de Midkine estaba negativamente relacionada con la actividad de AMPK y el pronóstico del paciente.