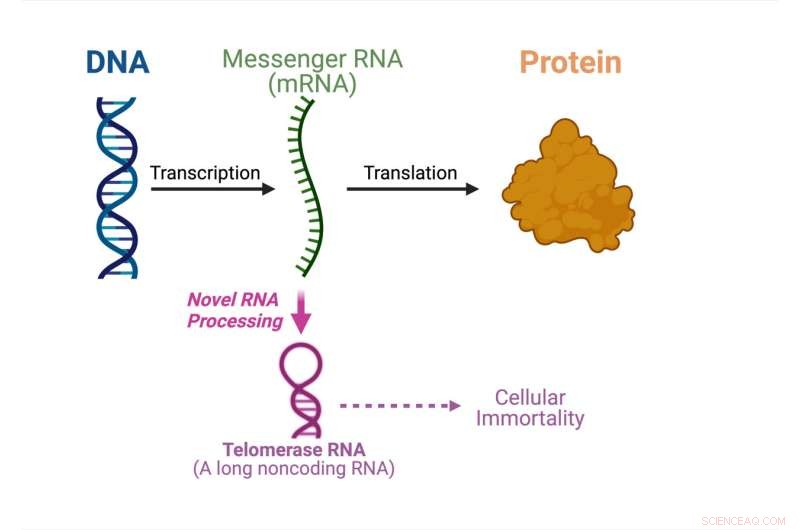
El dogma central de la biología molecular muestra lo que está sucediendo en este estudio. Crédito:Julián Chen
Por primera vez, un estudio dirigido por Julian Chen y su grupo en la Facultad de Ciencias Moleculares de la Universidad Estatal de Arizona y el Centro para el Mecanismo de Evolución del Instituto de Biodiseño, ha descubierto una vía sin precedentes que produce ARN de telomerasa a partir de un ARN mensajero que codifica proteínas ( ARNm).
El dogma central de la biología molecular especifica el orden en que la información genética se transfiere desde el ADN para formar proteínas. Las moléculas de ARN mensajero transportan la información genética desde el ADN en el núcleo de la célula hasta el citoplasma donde se fabrican las proteínas. El ARN mensajero actúa como mensajero para construir proteínas.
"En realidad, hay muchos ARN (ácidos ribonucleicos) que no se utilizan para fabricar proteínas", explicó Chen. "Alrededor del 70 por ciento del genoma humano se usa para producir ARN no codificantes que no codifican secuencias de proteínas pero tienen otros usos".
El ARN de la telomerasa es uno de los ARN no codificantes que se ensambla junto con las proteínas de la telomerasa para formar la enzima telomerasa. La telomerasa es crucial para la inmortalidad celular en el cáncer y las células madre. En este estudio, el grupo de Chen muestra que un ARN de telomerasa fúngica se procesa a partir de un ARNm que codifica una proteína, en lugar de sintetizarse de forma independiente.
"Nuestro hallazgo de este artículo es un cambio de paradigma. La mayoría de las moléculas de ARN se sintetizan de forma independiente y aquí descubrimos un ARNm de doble función que se puede usar para producir una proteína o para hacer un ARN de telomerasa no codificante, que es realmente único", dijo Chen. "Tendremos que investigar mucho más para comprender el mecanismo subyacente de una vía de biogénesis de ARN tan inusual".
La investigación básica sobre el metabolismo y la regulación del ARNm ha dado lugar a importantes aplicaciones médicas. Por ejemplo, varias vacunas contra la COVID-19 utilizan el ARN mensajero como medio para producir proteínas de pico viral. En estas vacunas, las moléculas de ARNm finalmente se degradan y luego son absorbidas por nuestro cuerpo.
Este nuevo enfoque tiene ventajas sobre las vacunas de ADN, que corren el riesgo potencial de incorporarse de manera nociva y permanente a nuestro ADN. El descubrimiento de la biogénesis de ARNm de doble función en este trabajo podría conducir a formas innovadoras de fabricar futuras vacunas de ARNm.
En este estudio, el grupo de Chen descubrió el inesperado ARN de la telomerasa derivado del ARNm en el organismo fúngico modelo Ustilago maydis. o carbón de maíz. El carbón de maíz, también llamado trufa mexicana, es comestible y agrega un delicioso efecto umami a muchos platillos, por ejemplo, tamales y tacos. El estudio de la biología del ARN y los telómeros en el carbón de maíz puede brindar oportunidades para encontrar nuevos mecanismos para el metabolismo del ARNm y la biogénesis de la telomerasa.
¿Por qué estudiar el ARN de la telomerasa?
El Premio Nobel de Fisiología o Medicina se otorgó en 2009 "por el descubrimiento de cómo los telómeros y la enzima telomerasa protegen los cromosomas". La telomerasa se aisló por primera vez de un organismo unicelular que vivía en la escoria de un estanque. Más tarde resultó que la telomerasa existe en casi todos los organismos eucariotas, incluidos los humanos, y desempeña un papel crucial en el envejecimiento y el cáncer. Los científicos se han esforzado por descubrir formas de utilizar la telomerasa para hacer que las células humanas sean inmortales.
Las células humanas típicas son mortales y no pueden renovarse para siempre. Como demostró Leonard Hayflick hace medio siglo, las células humanas tienen una vida replicativa limitada, y las células más viejas alcanzan este límite antes que las células más jóvenes. Este "límite de Hayflick" de la duración de la vida celular está directamente relacionado con el número de repeticiones de ADN únicas que se encuentran en los extremos de los cromosomas que contienen material genético. Estas repeticiones de ADN son parte de las estructuras protectoras, denominadas "telómeros", que protegen los extremos de los cromosomas de reordenamientos de ADN no deseados e injustificados que desestabilizan el genoma.
Cada vez que la célula se divide, el ADN telomérico se encoge y finalmente no logra asegurar los extremos cromosómicos. Esta reducción continua de la longitud de los telómeros funciona como un "reloj molecular" que cuenta hacia atrás hasta el final del crecimiento celular.
La disminución de la capacidad de crecimiento de las células está fuertemente asociada con el proceso de envejecimiento, y la reducción de la población celular contribuye directamente a la debilidad, la enfermedad y la insuficiencia orgánica.
Contrarrestar el proceso de reducción de los telómeros es la telomerasa, la enzima que tiene la clave única para retrasar o incluso revertir el proceso de envejecimiento celular. La telomerasa compensa el envejecimiento celular al alargar los telómeros, agregando repeticiones de ADN perdidas para agregar tiempo a la cuenta regresiva del reloj molecular, extendiendo efectivamente la vida útil de la célula.
La telomerasa alarga los telómeros al sintetizar repetidamente repeticiones de ADN muy cortas de seis nucleótidos (los componentes básicos del ADN) con la secuencia "GGTTAG" en los extremos del cromosoma a partir de una plantilla ubicada dentro del componente de ARN de la propia enzima.
El encogimiento gradual de los telómeros afecta negativamente la capacidad de replicación de las células madre humanas, las células que restauran los tejidos dañados y/o reponen los órganos envejecidos de nuestro cuerpo. La actividad de la telomerasa en las células madre adultas simplemente ralentiza la cuenta atrás del reloj molecular y no inmortaliza por completo a estas células. Por lo tanto, las células madre adultas se agotan en las personas mayores debido al acortamiento de la longitud de los telómeros, lo que resulta en un aumento del tiempo de curación y la degradación del tejido orgánico debido a poblaciones celulares inadecuadas.
Aprovechar todo el potencial de la telomerasa
Comprender la regulación y la limitación de la enzima telomerasa promete revertir el acortamiento de los telómeros y el envejecimiento celular con el potencial de extender la vida humana y mejorar el bienestar de las personas mayores.
Las enfermedades humanas que incluyen disqueratosis congénita, anemia aplásica y fibrosis pulmonar idiopática se han relacionado genéticamente con mutaciones que afectan negativamente la actividad de la telomerasa y/o aceleran la pérdida de longitud de los telómeros. Este acortamiento acelerado de los telómeros se parece mucho al envejecimiento prematuro con un mayor deterioro de los órganos y una vida útil más corta del paciente causada por poblaciones de células madre críticamente insuficientes. El aumento de la actividad de la telomerasa es aparentemente el medio más prometedor para tratar estas enfermedades genéticas.
Si bien el aumento de la actividad de la telomerasa podría devolver la juventud a las células envejecidas y curar enfermedades similares al envejecimiento prematuro, demasiado de algo bueno puede ser perjudicial para el individuo. Así como las células madre jóvenes usan la telomerasa para compensar la pérdida de longitud de los telómeros, las células cancerosas emplean la telomerasa para mantener su crecimiento aberrante y destructivo. El aumento y la regulación de la función de la telomerasa deberán realizarse con precisión, recorriendo una línea estrecha entre el rejuvenecimiento celular y un mayor riesgo de desarrollo de cáncer.
A diferencia de las células madre humanas, las células somáticas constituyen la gran mayoría de las células del cuerpo humano y carecen de actividad de telomerasa. La deficiencia de telomerasa de las células somáticas humanas reduce el riesgo de desarrollo de cáncer, ya que la telomerasa estimula el crecimiento descontrolado de células cancerosas. Por lo tanto, no se desean fármacos que aumenten la actividad de la telomerasa indiscriminadamente en todos los tipos de células. Los fármacos de molécula pequeña pueden examinarse o diseñarse para aumentar la actividad de la telomerasa exclusivamente dentro de las células madre para el tratamiento de enfermedades, así como terapias antienvejecimiento sin aumentar el riesgo de cáncer.
El estudio de la biogénesis del ARN de la telomerasa en el carbón de maíz puede revelar nuevos mecanismos para la regulación de la telomerasa y ofrecer nuevas direcciones sobre cómo modular o diseñar la telomerasa humana para innovaciones en el desarrollo de terapias contra el envejecimiento y el cáncer.
Este estudio, "Biogénesis del ARN de la telomerasa a partir de un precursor de ARNm codificador de proteínas", acaba de publicarse en Proceedings of the National Academy of Sciences. . El equipo de ASU incluye a los primeros autores postdoctorales Dhenugen Logeswaran y al exprofesor asistente de investigación Yang Li, a la estudiante de doctorado Khadiza Akhter, al expostdoctorado Joshua Podlevsky (actualmente en Sandia National Labs, Albuquerque, Nuevo México) y dos estudiantes de pregrado Tamara Olson y Katherine Fosberg.
Chen también comentó sobre el calibre de los estudiantes universitarios de ASU, Tamara Olson y Katherine Fosberg, que trabajaron en su laboratorio durante más de un año. "Pasaron mucho tiempo en el laboratorio y estuvieron completamente involucrados en nuestra investigación". Lo que las langostas pueden enseñarnos sobre la inmortalidad