
Desde la década de 1950, el aumento de la producción mundial de plástico ha ido paralelo a un aumento preocupante de los residuos plásticos. Solo en Estados Unidos, en 2017 se generaron la asombrosa cifra de 35 millones de toneladas de desechos plásticos, y solo una fracción se recicló o quemó, dejando a la mayoría languideciendo en los vertederos. El tereftalato de polietileno (PET), un contribuyente clave a los desechos plásticos, particularmente de los envases de alimentos, plantea importantes desafíos ambientales debido a su lenta descomposición y contaminación.
Se han intensificado los esfuerzos para abordar este problema, y los investigadores exploran soluciones innovadoras, como aprovechar el poder de los microorganismos y las enzimas para la degradación del PET. Sin embargo, las enzimas existentes a menudo se quedan cortas en términos de eficiencia, especialmente a temperaturas propicias para aplicaciones industriales.
Ingrese la cutinasa, una enzima prometedora conocida por su capacidad para descomponer el PET de manera efectiva. Derivada de organismos como Fusarium solani, la cutinasa ha demostrado un potencial notable para degradar el PET y otros sustratos poliméricos. Los avances recientes incluyen el descubrimiento de la cutinasa (LCC) del compost de hojas y ramas, que exhibe tasas de degradación de PET sin precedentes a altas temperaturas, y la IsPETase, que sobresale a temperaturas más bajas.
En un estudio reciente publicado en Catalysis Today , investigadores de NYU Tandon dirigidos por Jin Kim Montclare, profesor de ingeniería química y biomolecular, presentaron un novedoso flujo de trabajo de detección computacional que utiliza protocolos avanzados para diseñar variantes de LCC con capacidades mejoradas de degradación de PET similares a las de isPETase.
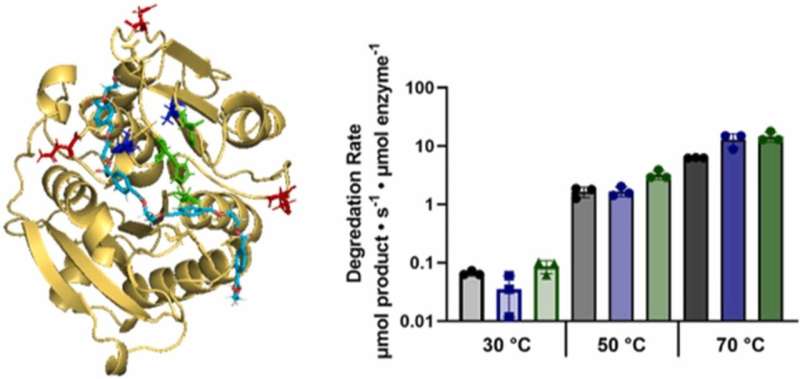
Al integrar modelos computacionales con ensayos bioquímicos, han identificado variantes prometedoras que exhiben un mayor comportamiento de hidrólisis, incluso a temperaturas moderadas.
Este estudio subraya el potencial transformador del cribado computacional en el rediseño de enzimas, ofreciendo nuevas vías para abordar la contaminación plástica. Al incorporar conocimientos de enzimas naturales como IsPETase, los investigadores están allanando el camino para el desarrollo de enzimas hidrolizantes de PET altamente eficientes con importantes implicaciones para la sostenibilidad ambiental.
Más información: Dustin Britton et al, Variantes de cutinasa de compost de hojas y ramas diseñadas con proteínas mediante detección computacional y homología IsPETase, Catalysis Today (2024). DOI:10.1016/j.cattod.2024.114659
Proporcionado por la Escuela de Ingeniería Tandon de la Universidad de Nueva York