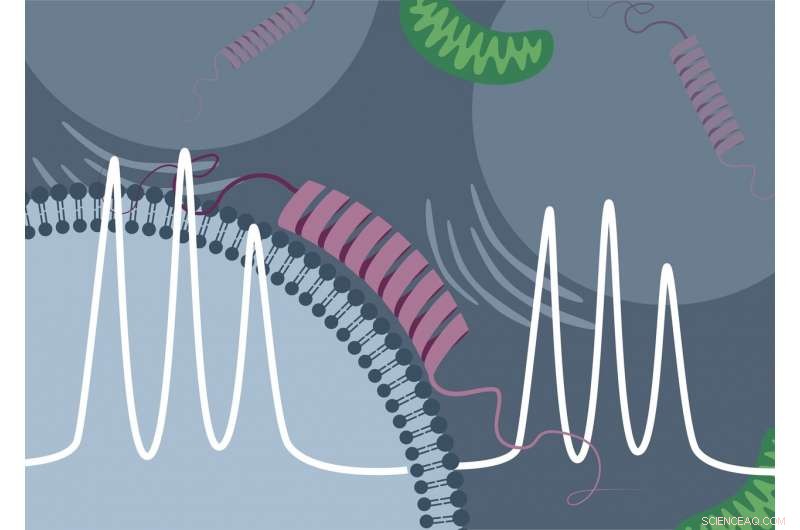
Científicos de la Universidad de Konstanz y la Universidad Libre de Amsterdam, en colaboración con el equipo de desarrollo de Bruker BioSpin, han tenido éxito por primera vez en la detección espectroscópica directa de la unión de la "proteína de Parkinson" α-sinucleína a las membranas lipídicas de la célula. Crédito:Malte Drescher Lab - Universidad de Konstanz
La proteína α-sinucleína es una de las proteínas más abundantes en el cerebro humano. A menudo se la conoce como la "proteína de Parkinson, "ya que el depósito de esta proteína en las células cerebrales es un sello distintivo de la enfermedad de Parkinson. A pesar del gran interés de la investigación biomédica en la proteína, Aún quedan por responder muchas preguntas sobre la función y fisiología de la α-sinucleína en las células vivas. Por ejemplo, Anteriormente no estaba claro si la proteína se une e interactúa con los componentes internos de la célula, como las membranas, y en qué medida.
Como tales procesos podrían desempeñar un papel en el desarrollo de la enfermedad, El equipo dirigido por el profesor Malte Drescher, químico físico con sede en Konstanz, utilizó el desarrollo adicional de un método de medición establecido llamado espectroscopía de resonancia paramagnética electrónica (espectroscopía EPR) para aprender más sobre las propiedades de unión de la proteína Parkinson. El estudio, publicado en la revista científica The Revista de letras de química física , proporciona una prueba de concepto de que el método avanzado es fundamentalmente adecuado para dilucidar las interacciones proteína-lípido en las células. Es más, esta primera prueba práctica arrojó evidencia directa de la unión de la α-sinucleína a las membranas intracelulares.
Más lento no siempre es más completo
La versión avanzada de espectroscopia EPR, en el estudio actual utilizado por primera vez en la práctica, se llama espectroscopia EPR de barrido rápido. En ambos métodos, lo convencional y lo avanzado, las proteínas que se van a estudiar se ajustan primero con las llamadas sondas de espín. Estas sondas químicas permiten detectar cambios en la estructura de las proteínas. Cada una de las sondas de espín tiene un electrón libre cuyo espín se excita por irradiación con microondas. "Podemos imaginar los giros como pequeñas agujas de una brújula que se ven influenciadas por la irradiación de microondas durante la medición, "Explica Drescher. En la espectroscopia EPR convencional, para cada grupo de giros excitados es necesario esperar hasta que esta influencia decaiga antes de que el grupo pueda volver a excitarse. Este proceso relativamente lento debe repetirse en muchas pasadas para lograr la medición completa.
Con espectroscopia EPR de barrido rápido, por el contrario, ya no es necesario esperar hasta que la influencia en un grupo de espín disminuya antes de continuar con la medición. "En lugar de, apresuras la influencia espectralmente de un grupo de espín a otro y luego regresas al primer grupo en el mismo momento en que su excitación acaba de disminuir, "dice Drescher. Por un lado, este procedimiento acorta el tiempo de medición requerido, mientras que por el otro permite la aplicación de una mayor potencia de microondas, conduciendo a una mayor precisión del método. Los investigadores han hecho uso de estas dos ventajas en su estudio actual sobre el comportamiento de unión de la α-sinucleína.
El nuevo método en la práctica
Por estudios previos realizados in vitro ("en el tubo de ensayo") ya se sabía que la "proteína de Parkinson" α-sinucleína puede unirse a membranas lipídicas cargadas eléctricamente negativamente. En espectroscopia EPR, este proceso de unión va acompañado de un cambio característico en la señal medida. "La α-sinucleína inicialmente desordenada asume una forma ordenada al unirse a la membrana. Esto reduce la movilidad de la sonda de espín, y la unión de la proteína puede detectarse directamente mediante el método de medición, "explica Theresa Braun, estudiante de doctorado en el equipo de investigación de Drescher y, junto con Juliane Stehle, autor principal del estudio.
Usando sintético, vesículas de membrana cargadas negativamente y α-sinucleína purificada, Drescher y sus colegas pudieron detectar el mismo cambio de señal en la espectroscopia EPR de barrido rápido. Sin embargo, tuvieron éxito no solo in vitro, sino también dentro de las células de la rana africana con garras (Xenopus laevis), en el que primero se introdujeron las vesículas de membrana artificial y, un corto tiempo después, la proteína era. Luego, el equipo de investigación llevó a cabo mediciones dependientes del tiempo y pudo observar directamente, basado en el cambio en la señal de medición, cómo la proporción de proteína unida a la célula aumentó con el tiempo.
También se observó un aumento comparable, aunque significativamente más débil, en la cantidad de α-sinucleína unida a lo largo del tiempo cuando no se introdujeron membranas artificiales en la célula. Por lo tanto, según Drescher, sólo quedaba una explicación para esta observación crucial. "Esta es la primera vez que vemos evidencia directa de que la α-sinucleína interactúa con el endógeno, es decir, también membranas lipídicas naturalmente existentes, ", concluye el científico. Debido al tamaño comparativamente pequeño del efecto, en experimentos con métodos de medición menos precisos, esto había permanecido oculto anteriormente.
De rana a humano
En estudios futuros, El equipo de Malte Drescher planea aprovechar este resultado y dilucidar aún más el proceso de unión intracelular de la α-sinucleína a los componentes celulares naturales. para aprender más sobre la función de la proteína. Un paso importante en este proceso será el paso de las células de rana como sistema modelo a varios tipos de células de mamíferos. El objetivo a largo plazo es comprender mejor las interacciones proteína-lípido de la "proteína de Parkinson" y su papel en el desarrollo de la enfermedad de Parkinson para poder desarrollar enfoques terapéuticos adecuados.