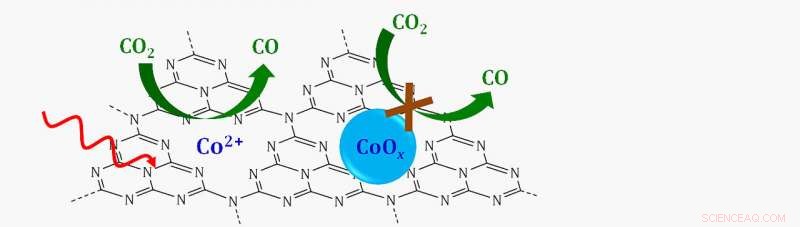
Esquema de un catalizador de sitio único en el que iones de cobalto individuales (CO 2 +) soportado sobre una capa de nitrógeno de carbono grafítico (C3N4) reduce el dióxido de carbono (CO 2 ) a monóxido de carbono (CO) en presencia de luz visible (flecha roja ondulada). Si el cobalto se uniera con oxígeno para formar un óxido de cobalto (CoOx), la reacción no continuaría. Crédito:Laboratorio Nacional Brookhaven
Un equipo de científicos ha descubierto un solo sitio, catalizador activado por luz visible que convierte dióxido de carbono (CO 2 ) en moléculas de "bloques de construcción" que podrían usarse para crear productos químicos útiles. El descubrimiento abre la posibilidad de utilizar la luz solar para convertir un gas de efecto invernadero en combustibles de hidrocarburos.
Los científicos utilizaron la Fuente de Luz Nacional Sincrotrón II, una instalación para usuarios de la Oficina de Ciencias del Departamento de Energía de EE. UU. (DOE) en el Laboratorio Nacional de Brookhaven, para descubrir detalles de la reacción eficiente, que utilizó un solo ion de cobalto para ayudar a reducir la barrera de energía para descomponer el CO 2 . El equipo describe este catalizador de sitio único en un artículo recién publicado en Revista de la Sociedad Química Estadounidense .
Conversión de CO 2 en partes más simples, monóxido de carbono (CO) y oxígeno, tiene valiosas aplicaciones en el mundo real. "Al romper el CO 2 , podemos matar dos pájaros de un tiro:eliminar el CO2 de la atmósfera y fabricar bloques de construcción para producir combustible, "dijo Anatoly Frenkel, químico con un cargo conjunto en Brookhaven Lab y Stony Brook University. Frenkel dirigió el esfuerzo por comprender la actividad del catalizador, que fue hecho por Gonghu Li, químico físico de la Universidad de New Hampshire.
"Ahora tenemos evidencia de que hemos fabricado un catalizador de un solo sitio. Ningún trabajo anterior ha reportado CO solar 2 reducción usando un solo ion, "dijo Frenkel.
Rompiendo los lazos que retienen el CO 2 juntos requiere mucha energía y mucho tiempo. Entonces, Li se propuso desarrollar un catalizador para reducir la barrera energética y acelerar el proceso.
"La pregunta es, entre varios catalizadores posibles, ¿Cuáles son eficientes y prácticos para implementar en la industria? ”, dijo Frenkel.
Un ingrediente clave necesario para romper los enlaces del CO 2 es un suministro de electrones. Estos electrones se pueden generar cuando un material conocido como semiconductor se activa mediante energía en forma de luz. La luz "expulsa" los electrones, por así decirlo, poniéndolos a disposición del catalizador para reacciones químicas. La luz del sol podría ser una fuente natural de tal luz. Pero muchos semiconductores solo pueden activarse con luz ultravioleta, que constituye menos del cinco por ciento del espectro solar.
"El desafío es encontrar otro material semiconductor donde la energía de la luz solar natural haga una combinación perfecta para expulsar los electrones, "Dijo Frenkel.
Los científicos también necesitaban que el semiconductor estuviera unido a un catalizador hecho de materiales que se podían encontrar abundantemente en la naturaleza. en lugar de raro, metales caros como el platino. Y querían que el catalizador fuera lo suficientemente selectivo para impulsar solo la reacción que convierte el CO 2 para co.
"No queremos que los electrones se utilicen para reacciones distintas a la reducción de CO 2 , "Dijo Frenkel.
Iones de cobalto unidos a nitruro de carbono grafítico (C3N4), un semiconductor hecho de carbono, nitrógeno, y átomos de hidrógeno, Marcó todas las casillas para estos requisitos.
"Ha habido un gran interés en utilizar C3N4 como semiconductor sin metales para recolectar luz visible e impulsar reacciones químicas, "Dijo Li." Los electrones generados por C3N4 bajo irradiación de luz tienen una energía lo suficientemente alta como para reducir el CO 2 . Dichos electrones a menudo no tienen una vida útil lo suficientemente larga como para permitirles viajar a la superficie del semiconductor para su uso en reacciones químicas. En nuestro estudio, Adoptamos una estrategia común y eficaz para acumular suficientes electrones energéticos para el catalizador mediante el uso de un donante de electrones de sacrificio. Esta estrategia nos permitió centrarnos en la catálisis de CO 2 reducción. Por último, Queremos utilizar moléculas de agua como donantes de electrones para nuestra catálisis. "añadió.
Peipei Huang, un investigador postdoctoral en el laboratorio de Li, hizo el catalizador simplemente depositando iones de cobalto en un material C3N4 hecho de urea disponible comercialmente. Luego, el equipo examinó exhaustivamente el catalizador sintetizado utilizando una variedad de técnicas en colaboración con Christine Caputo en la Universidad de New Hampshire y Ronald Grimm en el Instituto Politécnico de Worcester.
El catalizador trabajó en CO 2 reducción bajo irradiación de luz visible.
"Este catalizador hizo lo que se suponía que debía hacer:descomponer el CO 2 y producen CO con muy buena selectividad en luz visible, ", Dijo Frenkel." Pero el siguiente objetivo era ver por qué funcionaba. Si puede entender por qué funciona, puede crear materiales nuevos y mejores basados en esos principios ".
Así que Frenkel y Li intercambiaron ideas sobre experimentos que mostrarían la estructura del catalizador con precisión. Los estudios estructurales darían a los científicos información sobre el número de átomos de cobalto, su ubicación en relación con los átomos de carbono y nitrógeno, y otras características que los científicos podrían ajustar potencialmente para tratar de mejorar aún más el catalizador.
Recurrieron a la línea de luz de absorción y dispersión rápida de rayos X (QAS) en NSLS-II para utilizar la espectroscopia de absorción de rayos X. Con la ayuda del científico líder en líneas de luz Steven Ehrlich, El estudiante de Frenkel, Jiahao Huang, tomó los datos y analizó los espectros.
En esta técnica, los rayos X de NSLS-II son absorbidos por los átomos de la muestra, que luego expulsan ondas de electrones. Los espectros muestran cómo estas ondas de electrones interactúan con los átomos circundantes, similar a la forma en que las ondas en la superficie de un lago se interrumpen cuando se encuentran con rocas.
"Para poder hacer espectroscopía de absorción de rayos X (XAS), necesitamos sintonizar y escanear la energía del haz de rayos X que golpea la muestra, ", dijo Ehrlich." Cada elemento puede absorber rayos X a distintas energías, llamados bordes de absorción. En la nueva línea de luz QAS podemos escanear la energía de los rayos X a través de la energía del borde de absorción de diferentes elementos, como el cobalto en este caso. Luego medimos el número de fotones absorbidos por la muestra para cada valor de la energía de rayos X ".
Además, Frenkel explicó, "cada tipo de átomo produce un tipo diferente de ondulación electrónica, cuando está excitado por rayos X, o cuando lo golpean otras ondas, por lo que el espectro de absorción de rayos X le dice cuáles son los átomos circundantes, así como a qué distancia y cuántos hay ".
El análisis mostró que el catalizador que descompone el CO 2 estaba hecho de iones únicos de cobalto rodeados por todos lados por átomos de nitrógeno.
"No había pares de cobalto-cobalto. Entonces, esto era evidencia de que, de hecho, eran átomos únicos de cobalto dispersos en la superficie, "Dijo Frenkel.
"Estos datos también reducen los posibles arreglos estructurales, que proporciona información para que los teóricos evalúen y comprendan completamente las reacciones, "Añadió Frenkel.
Aunque la ciencia esbozada en el documento aún no está en uso práctico, hay abundantes posibilidades de aplicaciones, Dijo Frenkel. En el futuro, Tales catalizadores de un solo sitio podrían usarse en áreas a gran escala con abundante luz solar para descomponer el exceso de CO 2 en la atmósfera, similar a la forma en que las plantas descomponen el CO 2 y reutilizar sus componentes básicos para construir azúcares en el proceso de fotosíntesis. Pero en lugar de hacer azúcares, los científicos pueden utilizar los componentes básicos del CO para generar combustibles sintéticos u otros productos químicos útiles.