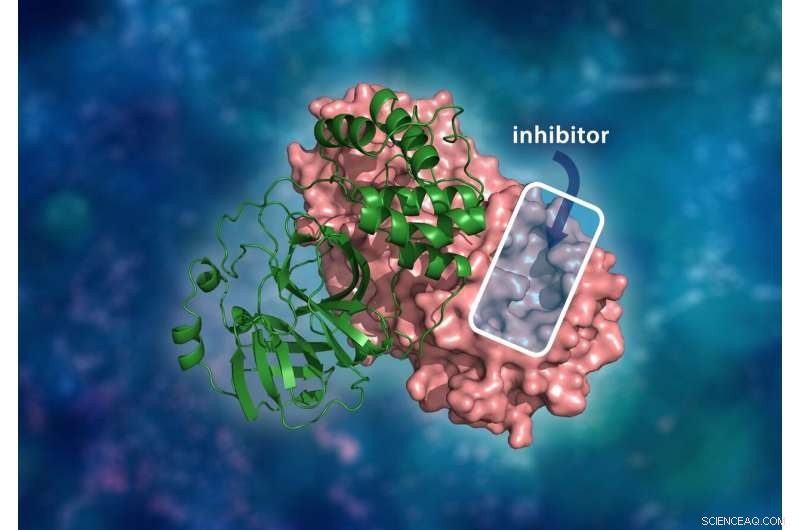
La estructura tridimensional de la proteasa principal SARS-CoV-2. El complejo de dímero molecular consiste en un solo monómero (verde) unido a otro monómero (rosa) donde un inhibidor de la droga se uniría a la cavidad del sitio catalítico para evitar que el virus se replique. Crédito:ORNL / Andrey Kovalevsky, Jill Hemman
A medida que el nuevo coronavirus continúa propagándose, los investigadores están buscando nuevas formas de detenerlo. Pero para dos científicos, mirar hacia el futuro significa inspirarse en el pasado.
En enero de 2020, Andrey Kovalevsky y Daniel Kneller, investigadores del Laboratorio Nacional Oak Ridge (ORNL) del Departamento de Energía (DOE), se estaban preparando para usar neutrones para estudiar la relación entre una determinada proteasa del VIH (una enzima proteica que permite que el virus se replique dentro del cuerpo humano) y una clase de medicamentos antirretrovirales conocidos como inhibidores de la proteasa del VIH. Algunos tipos de VIH desarrollan resistencia a estos medicamentos. El objetivo de los investigadores era comprender mejor cómo funcionan las variaciones de proteasa, para ayudar al desarrollo de tratamientos de vanguardia para dominar incluso las cepas más resistentes del VIH.
Cuando el equipo comenzó su trabajo, poco sabían que, casualmente, sus esfuerzos por estudiar el VIH los pondría rápidamente en un nuevo camino para abordar el COVID-19, la pandemia que ahora tiene al mundo bajo control.
Como resulta, la actividad enzimática de la proteasa que permite que el VIH se reproduzca, el mismo mecanismo que el equipo de Kovalevsky se estaba preparando para investigar con neutrones, es el mismo mecanismo de replicación empleado por el SARS-CoV-2, el virus que causa la enfermedad COVID-19.
Ahora, el equipo ha cambiado el enfoque del enfoque experimental que pretendían utilizar para estudiar el VIH para combatir la nueva amenaza global.
Los estudios sobre el VIH giran hacia el nuevo coronavirus
Kovalevsky ha estado estudiando el VIH durante 15 años. Como cristalógrafo de neutrones, estudia pequeñas muestras cristalizadas de materia biológica bombardeándolas con neutrones. La técnica de dispersión de neutrones es muy eficaz para revelar cómo está dispuesta la estructura atómica de una muestra y cómo se comportan sus átomos. Dependiendo del objetivo, Los conocimientos recopilados pueden ofrecer orientación sobre cómo mejorar o incluso suprimir ciertas propiedades de un material biológico.
Los neutrones son una herramienta ideal para estudiar estructuras y comportamientos biológicos debido a su aguda sensibilidad a elementos ligeros como el hidrógeno y su capacidad para sondear dichos materiales sin dañarlos.
En 2019, Kovalevsky se propuso estudiar el VIH de una manera que nunca antes se había hecho. El uso de la dispersión de neutrones inelástica le permitiría recopilar datos sobre la dinámica, o los movimientos, de una proteasa del VIH, lo que se sumaría a los datos de difracción de neutrones que había estado recopilando durante años. Tener información tanto estructural como de comportamiento (o dinámica) proporcionaría una imagen más completa de cómo funciona el virus y, Sucesivamente, podría conducir a nuevos avances en los tratamientos.
Después de usar el espectrómetro VISION en la fuente de neutrones de espalación (SNS) de ORNL, un instrumento de dispersión de neutrones que revela los movimientos de los átomos en función de sus vibraciones, Kovalevsky se dio cuenta de que necesitaba ayuda para analizar los datos.
"Daniel aporta su experiencia en la investigación de proteasas virales, ", explicó Kovalevsky sobre la contratación de Kneller." Él sabe cómo trabajar con las proteínas en el laboratorio. Conoce todas las técnicas de laboratorio en términos de producción de proteínas, purificación, cristalización, recopilación de datos cristalográficos, y análisis para obtener conocimientos sobre el diseño de fármacos ".
Tomó alrededor de 8 meses contratar a Daniel después de una búsqueda extensa, Dice Kovalevsky. Kneller, que se especializa en el estudio de la proteasa del VIH mediante cristalografía, se unió al equipo de Kovalevsky en enero de 2020 para ayudar con el trabajo experimental y computacional sobre la proteasa del VIH.
Pero justo cuando el equipo estaba listo para sumergirse, COVID-19 se había vuelto global, y la investigación llegó a un punto muerto.

El investigador postdoctoral Daniel Kneller está utilizando el Centro de Biología Estructural y Molecular de ORNL para sintetizar proteínas cristalizadas relacionadas con COVID-19 y prepararlas para estudios de dispersión de neutrones en la Fuente de Neutrones de Espalación y el Reactor de Isótopos de Alto Flujo. Crédito:ORNL / Carlos Jones
Cambio de marchas, obteniendo resultados tempranos
En marzo, El personal de Ciencias de Neutrones de ORNL desarrolló un plan para estudiar los componentes clave de COVID-19 reuniendo equipos de investigación y estableciendo nuevas prioridades en los programas operativos de los instrumentos esenciales en las dos instalaciones de dispersión de neutrones en ORNL. SNS y el reactor de isótopos de alto flujo (HFIR).
Habiendo sentado ya las bases para estudiar la proteasa, Kovalevsky y Kneller pasaron rápidamente del VIH al nuevo coronavirus. Específicamente, actualmente se centran en la proteasa principal del SARS-CoV-2, el virus que causa la enfermedad COVID-19.
"La proteasa del SARS-CoV-2 es una enzima que corta las proteínas que permiten que el virus se reproduzca. Comprender cómo se ensambla la proteasa y cómo funciona es un primer paso fundamental para encontrar fármacos inhibidores eficaces que bloqueen el mecanismo de replicación del virus, ", dijo Kovalevsky." Similar a la proteasa del VIH, la proteasa principal del virus SARS-CoV-2 es uno de los objetivos farmacológicos más atractivos en este momento para diseñar inhibidores específicos ".
Al igual que con el plan original del trabajo sobre el VIH, el equipo se está preparando para usar instrumentos en SNS y HFIR para obtener información fundamental sobre cómo se organizan los átomos en la proteasa. Usando los instrumentos MaNDi e IMAGINE, los investigadores podrán reconstruir la estructura atómica de la proteasa mediante el uso de neutrones para rastrear los átomos de hidrógeno dentro de las muestras de proteínas cristalizadas.
Pero primero, tienen que obtener cristales de alta calidad que sean lo suficientemente grandes para los experimentos con neutrones. Aquí es donde el equipo ha logrado avances significativos desde el principio.
La calidad del cristal se determina primero por lo bien que se difractan, o esparcir, Rayos X. Típicamente, este proceso se lleva a cabo en una instalación de sincrotrón, donde los cristales pueden congelarse a alrededor de 100 K (o alrededor de -280 ° F).
El equipo utilizó el laboratorio de Caracterización y Cristalización de Proteínas en SNS para cultivar cristales de proteasa SARS-CoV-2, lo que tomó alrededor de una semana a 10 días. Para analizar la calidad de los cristales, utilizaron la máquina de rayos X local, un HomeLab de Rigaku HighFlux, que proporcionó varios hallazgos clave.
Primero, Los experimentos de rayos X confirmaron que los cristales eran de alta calidad y que el método utilizado para cultivarlos podría producir cristales más grandes adecuados para experimentos de neutrones. Segundo, tener una máquina local les permitió recolectar mediciones de rayos X a temperatura ambiente, alrededor de 70 ° F.
Las mediciones de temperatura ambiente les permitieron observar la plasticidad, o flexibilidad, de la estructura de la proteasa, proporcionando información discernible sobre cómo se comporta la estructura en condiciones cercanas al entorno fisiológico del virus. Estos datos no podrían haberse obtenido utilizando muestras congeladas.
"Este es un hito importante en nuestro esfuerzo por realizar difracción de neutrones. La inversión en una máquina de rayos X local ha valido la pena, ", dijo Kneller." En un caso, cultivamos cristales el lunes y recopilamos datos sobre ellos el martes. De lo contrario, para obtener esa información tendrías que enviar tus cristales a un sincrotrón, lo que podría llevar días o semanas ".
"Y en este momento, por la pandemia, no puedes ir a un sincrotrón, "añadió Kovalevsky." Y para analizar cristales a temperatura ambiente, Tienes que estar allí."
"La información que aprendimos de la estructura a temperatura ambiente tiene la capacidad de impactar inmediatamente las direcciones computacionales que están usando los investigadores. Encontramos algunas diferencias entre nuestra estructura casi fisiológica a temperatura ambiente y las estructuras congeladas de los sincrotrones, que puede ser importante para el trabajo computacional, como los estudios de acoplamiento de moléculas pequeñas que se están realizando en la Cumbre de supercomputadoras de ORNL, "dijo Kneller.

Vista microscópica de los cristales de proteasa SARS-CoV-2 cultivados en el laboratorio de Caracterización y Cristalización de Proteínas de ORNL. Una vez que los cristales alcanzan un cierto tamaño y forma, se utilizarán en experimentos de dispersión de neutrones para determinar cómo está estructurada la proteasa principal del SARS-CoV-2 y cómo se comporta. Crédito:ORNL / Daniel Kneller
"Hasta aquí, hemos tenido mucho éxito en nuestros primeros estudios de COVID-19. Ya hemos enviado un manuscrito para su publicación sobre nuestros hallazgos estructurales, en el que básicamente hemos realizado dos meses de investigación que normalmente podrían haber llevado un año ".
Leighton Coates ayudó a Kovalevsky y Kneller en el análisis de datos y estructura de los cristales de proteína, un científico de instrumentos en el difractómetro SNS MaNDi que también es miembro del equipo cristalográfico que estudia la proteasa SARS-CoV-2.
Los datos generados durante los próximos meses se compartirán con otros laboratorios nacionales, universidades y la comunidad científica en general para construir modelos más precisos para simulaciones computacionales que se utilizan para identificar posibles candidatos a fármacos para detener el virus.
"La comunidad científica ha respondido rápidamente a la pandemia de COVID-19. Tenemos la suerte de poder hacer nuestras propias contribuciones aprovechando años de experiencia en el estudio del VIH para comprender mejor cómo se replica el nuevo coronavirus y cómo podemos combatirlo inhibiendo su proteasa esencial, "dijo Kovalevsky.
Investigando la resistencia al VIH
Antes de que la pandemia centrara su atención y sus esfuerzos en la investigación del SARS-CoV-2, Kovalevsky y Kneller tenían un plan claro para atacar el VIH.
Treinta y nueve millones de personas en todo el mundo están infectadas por el VIH. Brindar a estas personas mejores opciones de tratamiento no solo mejoraría su calidad de vida, sino que también evitaría que esta enfermedad se propague aún más.
La proteasa del VIH actúa escindiendo inofensivamente, o no funcional, hebras de proteínas en proteínas más pequeñas, convirtiéndolas en proteínas virales funcionales que permiten que el virus se ensamble y continúe infectando células humanas sanas. En general, Los inhibidores de la proteasa del VIH son bastante eficaces para bloquear la proteasa durante la replicación del VIH, pero algunas variaciones de proteasa han desarrollado la capacidad de resistir inhibidores de fármacos.
"Si podemos aprender más sobre los mecanismos moleculares que hacen que las variantes de la proteasa del VIH sean resistentes a los medicamentos, podemos diseñar medicamentos que estén mejor equipados para burlar sus defensas, "dijo Kneller.
Específicamente, Kneller y Kovalevsky querían explorar PRS-17, una variante única de la proteasa del VIH que es 10, 000 veces menos probable que otras variantes no resistentes de ser inhibidas por los inhibidores clínicos de la proteasa del VIH más eficaces disponibles en la actualidad. Kovalevsky explicó que si bien los programas de tratamiento del VIH han avanzado mucho desde que comenzó la pandemia del VIH en la década de 1980, variantes mutantes como PRS-17, como resultado de un tratamiento prolongado, podría comprometer años de innovación y progreso farmacéuticos y resultar en terapias antivirales fallidas.
"La resistencia a los medicamentos es ahora el mayor problema para los pacientes con VIH. Con el tratamiento adecuado, los pacientes pueden vivir una vida larga y feliz con niveles indetectables de VIH en su sistema. No desarrollarán el SIDA ni transmitirán el VIH a otras personas. Pero el PRS-17 y otras variantes de la proteasa del VIH resistentes a los medicamentos dificultan que los médicos combatan el VIH en sus pacientes. "dijo Kovalevsky.
Comprender exactamente cómo PRS-17 neutraliza la eficacia de los inhibidores de la proteasa del VIH es difícil, dicen los investigadores. Las proteínas constituyentes de los virus son sistemas complejos, y PRS-17 tiene la capacidad de emplear varios mecanismos diferentes para protegerse contra los fármacos antirretrovirales.
"Descubrir cómo PRS-17 resiste a los inhibidores de la proteasa del VIH es un desafío, pero uno que absolutamente tenemos que superar. PRS-17 es un aislado clínico, lo que significa que provino de un paciente real que lucha por combatir esta enfermedad, ", explicó Kneller." Aprender más sobre este tema podría salvar la vida de muchos pacientes, porque el conocimiento que obtenemos usando neutrones en PRS-17 será transferible a otras variantes de proteasa similares extremadamente resistentes a los medicamentos ".
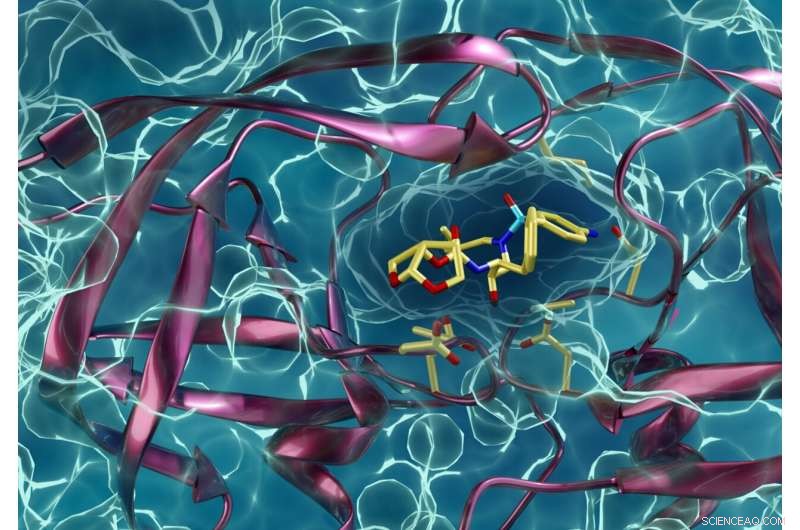
Tipo de proteasa del VIH resistente a los medicamentos que interactúa con un inhibidor de la proteasa del VIH. Kneller y Kovalevsky esperan que las mismas técnicas que han utilizado para aprender más sobre el VIH también ayuden a sus colegas investigadores a luchar contra el COVID-19. Crédito:ORNL / Jill Hemman
El equipo tenía la intención de crear un mapa de la proteasa PRS-17 para comprender mejor los mecanismos moleculares detrás de su resistencia a los medicamentos. Eso implicó el uso de los instrumentos MaNDi y VISION en SNS y el instrumento IMAGINE en HFIR.
"Era el mismo enfoque que estamos probando ahora con COVID-19, "dijo Kovalevsky.
Con MaNDi e IMAGINE, Kneller y Kovalevsky planeaban sondear muestras cristalizadas de proteasa PRS-17 para generar datos detallados sobre su estructura atómica estática. El uso de VISION les permitiría sondear muestras en polvo de proteasa PRS-17 para proporcionar información sobre sus propiedades dinámicas midiendo las vibraciones moleculares.
Los neutrones son particularmente adecuados para estudiar componentes de virus como el VIH (o SARS-CoV-2) debido a su sensibilidad al hidrógeno, un componente importante de todas las proteínas. Con cristalografía de neutrones, el equipo pudo ubicar con precisión cada átomo de hidrógeno dentro de la proteasa de PRS-17, dándoles información sin precedentes sobre cómo funciona la proteína y qué interacciones experimenta con un inhibidor de proteasa.
"Utilice cristalografía de neutrones en MaNDi e IMAGINE para localizar átomos de hidrógeno en cristales de proteasa PRS-17, nos permitiría construir un perfil completo de su estructura estática, "dijo Kneller." Con VISION, también rastrearíamos átomos de hidrógeno, pero usaríamos muestras en polvo de proteasa PRS-17 que se han rehidratado para imitar las condiciones de hacinamiento de una partícula viral del VIH. Eso nos permitiría ver sus propiedades dinámicas y aprender más sobre cómo podría moverse cuando está trabajando dentro de una partícula viral ".
Kneller explicó que obtener información sobre las propiedades estáticas y dinámicas de PRS-17 es importante para desarrollar una comprensión completa de la resistencia de este virus a los medicamentos antirretrovirales.
"Si rastreara tu ubicación solo una vez al día a medianoche, Creo que pasa todo su tiempo en casa. Pero en serio, te mueves bastante durante el día. Por eso es importante recopilar mediciones tanto estáticas como dinámicas de nuestra muestra. Nos permite construir una imagen más completa del comportamiento de la proteasa, "dijo Kneller.
"Sin cristalografía de neutrones, los investigadores tienen que hacer conjeturas sobre dónde están los átomos de hidrógeno en una proteína cada vez que intentan comprender cómo la proteína hace su trabajo, ", añadió Kneller." Este tipo de experimentos que Andrey ha realizado anteriormente han podido confirmar la ubicación de estos átomos de hidrógeno en variantes de proteasa del VIH no resistentes, pero nunca en una variante de proteasa extremadamente resistente a los fármacos. Eso significa que podríamos producir datos verdaderamente únicos y novedosos sobre esta proteasa ".
Kneller y Kovalevsky esperan algún día generar datos a través de sus experimentos que se convertirán en un recurso invaluable para los investigadores que buscan combatir cepas de VIH resistentes a los medicamentos.
"Es un esfuerzo de equipo. Químicos, biólogos, y los profesionales de la industria farmacéutica deben trabajar juntos para combatir las enfermedades, "dijo Kneller." Juntos, podemos desarrollar tratamientos eficaces para las cepas del VIH resistentes a los medicamentos ".
La investigación fue apoyada por la Oficina de Ciencias del DOE a través del Laboratorio Nacional de Biotecnología Virtual, un consorcio de laboratorios nacionales del DOE enfocados en la respuesta al COVID-19, con fondos proporcionados por la Ley CARES de Coronavirus.