Crédito:CEA
Después de 40 años de investigación, investigadores del CEA, CNRS, Universidad de Grenoble-Alpes, La Universidad de Montpellier e Inserm finalmente han identificado la enzima responsable de la destirosinación de tubulina. Asombrosamente, no es una enzima sino dos las que controlan la modificación de este componente esencial de la estructura citoesquelética. Este trabajo abre nuevas perspectivas para una mejor comprensión del papel que desempeña la tubulina, cuya desregulación se ha relacionado con cánceres, enfermedades cardiovasculares y trastornos neurales.
Un proyecto internacional de colaboración que involucra a investigadores de CEA (Comisión Francesa de Energía Atómica), CNRS (Centro Nacional Francés de Investigaciones Científicas), Inserm (Instituto Nacional Francés de Salud e Investigación Médica), Universidad de Grenoble-Alpes, La Universidad de Montpellier y la Universidad de Stanford han identificado la enzima, Tubulin Carboxipeptidasa (TCP), responsable de la transformación bioquímica de los microtúbulos celulares, a través de la destirosinación. La destirosinación es una reacción biológica que resulta en la eliminación del aminoácido terminal tirosina de la α-tubulina, una de las subunidades que componen los microtúbulos. Después de cuatro décadas de investigación, Los biólogos finalmente han logrado purificar esta proteína, y han pasado a proporcionar pruebas de su actividad celular.
Los microtúbulos contribuyen a las funciones celulares esenciales.
Los microtúbulos son fibras dinámicas presentes en todas las células, están formados por la combinación de dos proteínas (α-tubulina y β-tubulina). Los microtúbulos cumplen numerosas funciones:separan los cromosomas para distribuirlos entre las dos células hijas durante la división celular; contribuyen a la polaridad celular, morfología y migración celular; también forman una red dentro de la celda, sobre qué constituyentes celulares, como proteínas o cadenas de ARN, puede ser transportado.
Estas funciones celulares están reguladas por "señales" que están presentes en la superficie de los microtúbulos. Estas señales, que consiste en modificaciones bioquímicas de los aminoácidos (conocidas como modificaciones postraduccionales, ya que tienen lugar después de la síntesis de proteínas), ocurren en múltiples sitios en las células y son ejecutadas por una amplia gama de enzimas; en este caso, las enzimas modifican las tubulinas.
La enzima TCP, finalmente identificado después de 40 años de misterio
La actividad de una de estas enzimas fue identificada por primera vez en 1977 por un equipo de investigación argentino. Llamaron a esta actividad "TCP" (Tubulin CarboxyPeptidase). Se demostró que esta enzima realiza la reacción de destirosinación:eliminación del aminoácido terminal, una tirosina, desde el final de la α-tubulina, pero la proteína en sí estaba por identificar (se desconocía su tamaño y secuencia). Otra enzima, la ligasa TTL, realiza la reacción inversa - tirosinación - a través de la cual se reemplaza la tirosina. El ciclo de destirosinacion / tirosinacion es vital para la celula y el organismo en su conjunto. La destirosinación masiva (anormal) se observa en varios tipos de cáncer graves y en enfermedades cardiovasculares.
Por lo tanto, la identificación y caracterización de TCP fue un objetivo importante para los investigadores que deseaban comprender la función fisiológica de la destirosinación de α-tubulina y determinar las consecuencias de su inhibición.
Para aislar TCP, los investigadores monitorearon su actividad, utilizó técnicas bioquímicas convencionales, y colaboró con químicos de la Universidad de Stanford, quien desarrolló una pequeña molécula que inhibe su actividad. Esta molécula se utilizó luego como cebo para "atrapar" la esquiva enzima.
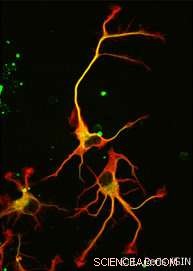
En el final, ni uno, pero se descubrieron dos enzimas. VASH1 y VASH2 ya eran conocidos por los científicos, pero no se habían asociado previamente con el citoesqueleto. Los investigadores demostraron que, cuando se asocia con una proteína asociada llamada SVBP, VASH1 y VASH2 pueden causar destirosinación de α-tubulina. Para demostrar esta actividad, el equipo inhibió la expresión de VASH1 / 2 (o su pareja SVBP) en neuronas. En ambos casos, Se observó una fuerte disminución en el nivel de destirosinación de α-tubulina junto con una morfología neuronal alterada (ver Figura). Los investigadores continuaron demostrando que estas enzimas también están involucradas en el desarrollo de la corteza cerebral.
Por lo tanto, 40 años después de que se presentó la primera evidencia de destirosinación de α-tubulina, se han identificado las enzimas responsables. Los científicos ahora esperan que, Modulando la actividad de TCP y mejorando su conocimiento del ciclo de destirosinación / tirosinación, podrán desarrollar nuevos tratamientos para cánceres específicos, y comprender mejor sus funciones cerebrales y cardíacas.