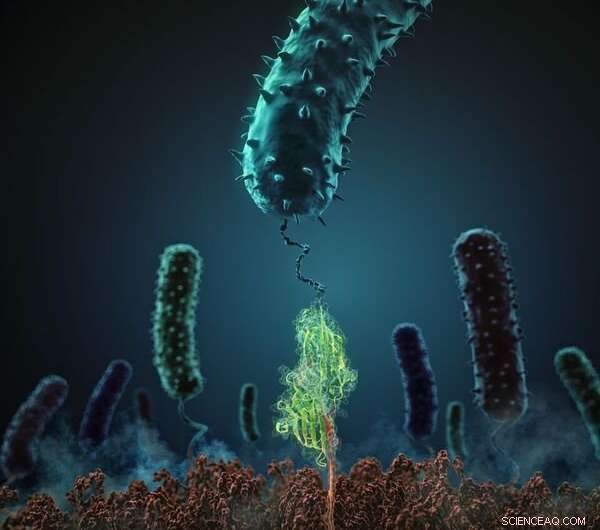
Esta figura muestra cómo estafilocócica La proteína de adhesión (en verde) interactúa con su ligando peptídico afín (rojo). Crédito:H. Gaub, LMU Múnich
Investigadores de Ludwig-Maximilians-Universitaet (LMU) en Munich, Alemania, han caracterizado el mecanismo físico que permite que un patógeno bacteriano extendido se adhiera a los tejidos de su huésped humano.
Los patógenos bacterianos han desarrollado estrategias altamente efectivas que les permiten adherirse a las células diana y a los nichos en los tejidos de sus organismos hospedadores. Incluso hacen uso de principios físicos relativamente desconocidos, como un nuevo estudio en la revista Ciencias demuestra. En colaboración con científicos de la Universidad de Illinois en Urbana-Champaign, Lukas Milles y el profesor Hermann Gaub de la Facultad de Física de LMU han descubierto el mecanismo que permite que la bacteria Staphyloccus epidermidis se una con tanta tenacidad a los tejidos del huésped. En efecto, el equipo no solo ha identificado la base física de la interacción, pero también caracterizó el mecanismo de adherencia con un detalle sin precedentes.
Esta hazaña fue posible gracias al novedoso enfoque de dos vertientes utilizado en el estudio. Los investigadores utilizaron microscopía de fuerza atómica para medir la fuerza de unión entre una proteína de adhesión estafilocócica (SdrG de Staphylococcus epidermidis) y su ligando afín (fibrinógeno β) a nivel de molécula única in vitro. y calculó las contribuciones de todos los átomos involucrados en la interacción in silico, con la ayuda de una supercomputadora especialmente potente. "Este paradigma innovador genera conocimientos que antes eran inalcanzables, "Señala Gaub. Para diseccionar el mecanismo de adhesión, la supercomputadora Blue Waters de la Universidad de Illinois, con sus 900, 000 procesadores uno de los más avanzados del mundo, llevó a cabo simulaciones detalladas de dinámica molecular. La tenacidad de la interacción sorprendió al equipo. "La fuerza de unión mecánica que mantiene los componentes de un solo complejo juntos asciende a más de 2 nanonewtons (nN). Este es un valor extraordinario para una interacción no covalente, comparable a la fuerza de los enlaces covalentes entre átomos, cuáles son los enlaces moleculares más estables que conocemos, "dice Gaub.
El estudio muestra que, gracias a la geometría de la interacción, la proteína de adhesión forma una densa red de enlaces de hidrógeno no covalentes con su ligando. Es más, esta red está mediada por los enlaces peptídicos que forman la columna vertebral repetida de la proteína, en lugar de las cadenas laterales variables que diferencian sus subunidades de aminoácidos. La gran cantidad de interacciones locales involucradas conduce a un endurecimiento de cada enlace de hidrógeno, lo que da lugar a lo que los físicos denominan "una geometría de cizallamiento cooperativa". "Este tipo de estructura puede soportar tensiones extremas, porque todos los lazos individuales deben romperse a la vez para separar el complejo, "como explica Lukas Milles. El mecanismo es análogo a la interacción entre los muchos pequeños ganchos y lazos en dos tiras de velcro, que son extremadamente difíciles de separar cuando se tiran de extremos opuestos. "La bacteria utiliza un mecanismo muy inusual, que es a la vez extremadamente intrincado y muy eficaz, y dota al patógeno de una ventaja decisiva, ", dice Gaub. Dado que el mecanismo se basa en las cadenas principales de péptidos de las moléculas que interactúan, que es común a todas las proteínas, este nivel de estabilidad se puede lograr en interacciones con un amplio espectro de objetivos. En otras palabras, la resistencia mecánica extremadamente alta de la interacción es en gran medida independiente tanto de la secuencia de aminoácidos de la proteína de adhesión como de las propiedades bioquímicas del péptido diana.
Los estafilococos son responsables de una amplia gama de infecciones en animales y seres humanos. "Las bacterias patógenas se unen a moléculas diana en las células huésped con una persistencia inusual, y esto tiene su base en principios físicos. En la búsqueda de formas de bloquear infecciones invasivas, una mejor comprensión de los principios físicos involucrados es vital, "dice Hermann Gaub. Así, El nuevo estudio sienta las bases para el desarrollo de nuevas terapias para el tratamiento de infecciones estafilocócicas.