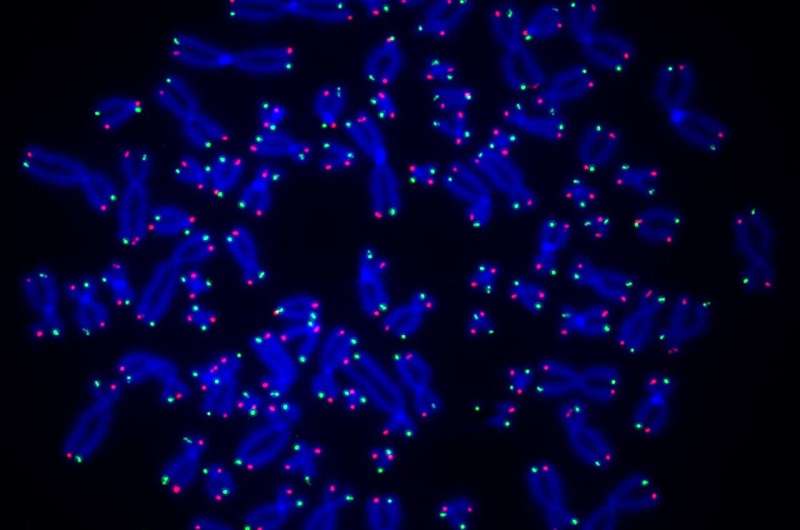
Un nuevo estudio dirigido por investigadores de la Universidad de Pittsburgh y del UPMC Hillman Cancer Center muestra que una enzima llamada PARP1 participa en la reparación de los telómeros, las longitudes de ADN que protegen las puntas de los cromosomas, y que alterar este proceso puede provocar un acortamiento de los telómeros y una alteración genómica. inestabilidad que puede provocar cáncer.
El trabajo de PARP1 es la vigilancia del genoma:cuando detecta roturas o lesiones en el ADN, añade una molécula llamada ADP-ribosa a proteínas específicas, que actúan como una baliza para reclutar otras proteínas que reparan la rotura. Los nuevos hallazgos, publicados en Nature Structural &Molecular Biology , son la primera evidencia de que PARP1 también actúa sobre el ADN telomérico, abriendo nuevas vías para comprender y mejorar las terapias contra el cáncer que inhiben PARP1.
"Nadie pensó que la ribosilación de ADP en el ADN fuera posible, pero hallazgos recientes desafían este dogma", dijo Roderick O'Sullivan, Ph.D., profesor asociado de farmacología molecular Pitt e investigador de UPMC Hillman. "PARP1 es uno de los objetivos biomédicos más importantes para la investigación del cáncer, pero se pensaba que los medicamentos dirigidos a esta enzima solo actuaban en las proteínas. Ahora que sabemos que PARP1 también modifica el ADN, cambia el juego porque potencialmente podemos atacar este aspecto de PARP1. biología para mejorar los tratamientos contra el cáncer."
En las células normales, las lesiones genómicas ocurren naturalmente durante la replicación del ADN cuando una célula se divide, y PARP1 juega un papel importante en la corrección de estos errores. Pero mientras que las células sanas tienen otras vías de reparación del ADN a las que recurrir, los cánceres con deficiencia de BRCA (que incluyen muchos tumores de mama y de ovario) dependen en gran medida de PARP1 porque carecen de proteínas BRCA, que controlan la forma más eficaz de reparación del ADN llamada replicación homóloga.
"Cuando las células cancerosas no pueden producir proteínas BRCA, se vuelven dependientes de las vías de reparación en las que participa PARP1", dijo O'Sullivan. "Entonces, cuando se inhibe PARP1, que es el mecanismo de varios medicamentos contra el cáncer aprobados, las células cancerosas no tienen una vía de reparación disponible y mueren".
Aunque los científicos descubrieron el papel de PARP1 en la ribosilación de proteínas por ADP hace unos 60 años, O'Sullivan y su colaborador, Ivan Ahel, Ph.D., profesor de la Escuela de Patología Sir William Dunn de la Universidad de Oxford y experto en PARP1, Tenía el presentimiento de que había más que aprender sobre esta enzima y su papel en las células.
O'Sullivan y su equipo, dirigido por Anne Wondisford, Ph.D., estudiante de posgrado en el Programa de Capacitación Médico-Científica de Pitt, compararon por primera vez células humanas normales con aquellas deficientes en PARP1. Utilizando anticuerpos especiales que se unen a la ADP-ribosa y a sondas específicas de los telómeros, descubrieron que la ADP-ribosa se une al ADN telomérico en las células normales, pero no en las células con deficiencia de PARP1, lo que demuestra que esta enzima es responsable de la ribosilación del ADN por ADP. /P>
A continuación, compararon las células normales con aquellas deficientes en otra enzima llamada TARG1, que elimina la ADP-ribosa. En ausencia de TARG1, la ADP-ribosa se acumuló en los telómeros, lo que provocó una interrupción de la replicación de los telómeros y un acortamiento prematuro de los telómeros.
Para demostrar que estos defectos de los telómeros se debían a la modificación del ADN telomérico, O'Sullivan y su equipo tomaron enzimas bacterianas que funcionan de manera similar a PARP1 y las introdujeron en células humanas.
"Utilizamos un sistema de guía para dirigir las enzimas para que agreguen ADP-ribosa sólo en los telómeros y en ningún otro lugar del genoma", dijo O'Sullivan. "Descubrimos que si cargamos los telómeros con ADP-ribosa, su integridad se ve dramáticamente afectada y puede matar la célula en cuestión de días".
O'Sullivan plantea la hipótesis de que la ADP-ribosa afecta la integridad de los telómeros al alterar una estructura protectora llamada refugio que protege los telómeros, pero se necesita más investigación para confirmar esto.
"Dirigirse a PARP1 ha sido un gran éxito para la terapia contra el cáncer, pero algunos pacientes desarrollan resistencia a los inhibidores de PARP1", dijo O'Sullivan. "Estoy entusiasmado con este estudio porque hemos descubierto algo nuevo sobre la biología de PARP1, lo que genera una gran cantidad de nuevas preguntas que podrían ayudarnos a desarrollar enfoques novedosos para atacar a PARP1 o perfeccionar las terapias que ya tenemos. Estamos en lo cierto "Es el comienzo de algo emocionante y hay mucho más por explorar".
Otros autores del estudio fueron Sandra Schamus-Haynes, Ragini Bhargava Ph.D. y Patricia Opresko, Ph.D., todas de Pitt y UPMC; Junyeop Lee y Jaewon Min, Ph.D., ambos de la Universidad de Columbia; Robert Lu, Ph.D. e Hilda Pickett, Ph.D., ambos de la Universidad de Sydney; y Marion Schuller, D.Phil., y Josephine Groslambert, ambas de la Universidad de Oxford.
Más información: La desregulación de la ribosilación del ADP del ADN altera la replicación de los telómeros, Biología estructural y molecular de la naturaleza (2024). DOI:10.1038/s41594-024-01279-6
Información de la revista: Naturaleza Biología estructural y molecular
Proporcionado por la Universidad de Pittsburgh