Se sabe que el mal funcionamiento de las proteínas FLVCR1 y FLVCR2 provoca en humanos enfermedades hereditarias raras que provocan trastornos motores, sensoriales y neurológicos. Sin embargo, los mecanismos bioquímicos detrás de esto y las funciones fisiológicas de las proteínas FLVCR no han estado claros hasta la fecha.
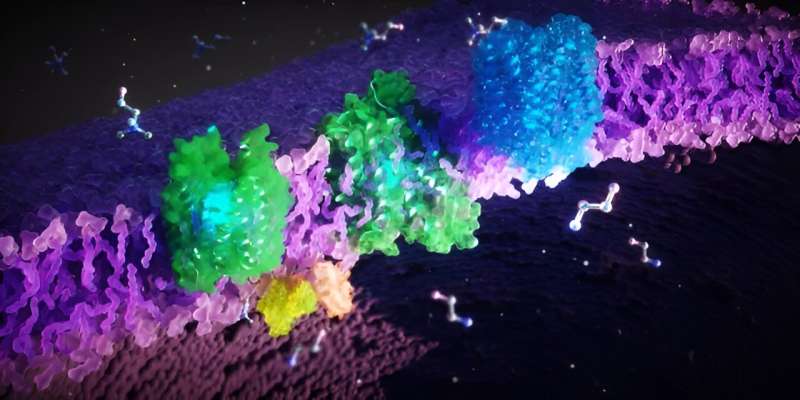
Un equipo interdisciplinario de investigadores de Frankfurt am Main, Singapur y Estados Unidos ha descifrado las estructuras 3D de las proteínas FLVCR y sus funciones celulares. Los investigadores han demostrado que las proteínas transportan los componentes básicos de las células, colina y etanolamina. Sus hallazgos contribuyen significativamente a comprender la patogénesis de enfermedades raras y desarrollar nuevas terapias.
En las series de televisión sobre hospitales, los médicos buscan diagnósticos correctos y posibles tratamientos para pacientes con síntomas a veces desconcertantes o extraños. En realidad, este proceso suele tardar años en quienes padecen enfermedades raras. En muchos casos, no existe medicación eficaz y las opciones terapéuticas son limitadas.
Aproximadamente entre el 6% y el 8% de la población mundial padece una enfermedad rara. Esto equivale a unos 500 millones de personas, aunque cada una de las más de 7.000 enfermedades diferentes sólo afecta a aproximadamente 1 de cada 2.000 personas. Dado que estas enfermedades son tan raras, el conocimiento médico y científico sobre ellas es limitado. Hay sólo unos pocos expertos en todo el mundo y falta conciencia social.
Un equipo internacional de investigadores dirigido por Schara Safarian, líder de grupo de proyecto en el Instituto Max Planck de Biofísica, así como líder de grupo independiente en el Instituto Fraunhofer de Medicina Traslacional y Farmacología ITMP y el Instituto de Farmacología Clínica de la Universidad Goethe de Frankfurt, ha investigó la estructura y función celular de dos proteínas, FLVCR1 y FLVCR2, que desempeñan un papel causal en una serie de enfermedades hereditarias raras.
Los científicos han publicado sus hallazgos en Nature .
El mal funcionamiento de FLVCR1 y FLVCR2 debido a mutaciones genéticas causa enfermedades raras, algunas de las cuales resultan en trastornos visuales, de movilidad y sensoriales graves, como ataxia de la columna posterior con retinosis pigmentaria, síndrome de Fowler o neuropatías sensoriales y autonómicas. Esto último puede provocar, por ejemplo, una pérdida total de la sensación de dolor.
"En muchas enfermedades, incluidas las raras, las estructuras celulares de nuestro cuerpo se modifican y esto provoca disfunciones en los procesos bioquímicos", afirma Schara Safarian. "Para comprender el desarrollo de este tipo de enfermedades y desarrollar terapias, necesitamos saber cómo se estructuran estas proteínas a nivel molecular y qué funciones desempeñan en las células sanas."
Los científicos han descubierto que FLVCR 1 y FLVCR2 transportan las moléculas colina y etanolamina a través de las membranas de nuestras células. "La colina y la etanolamina son esenciales para funciones corporales importantes. Apoyan el crecimiento, la regeneración y la estabilidad de nuestras células, por ejemplo en los músculos, los órganos internos y el cerebro", explica Safarian.
"Además, la colina interviene en el metabolismo de las grasas y en la desintoxicación del hígado. Nuestro cuerpo también la necesita para producir el neurotransmisor acetilcolina, que es crucial para nuestro sistema nervioso y que nuestro cerebro necesita para controlar los órganos. Así que puedes imaginar que las disfunciones de las proteínas FLVCR puede provocar graves trastornos neurológicos y musculares."
Los investigadores utilizaron métodos microscópicos, bioquímicos y asistidos por computadora para investigar las proteínas FLVCR. "Congelamos las proteínas y luego las observamos con un microscopio electrónico", explica Di Wu, investigador del Instituto Max Planck de Biofísica y coautor del estudio. "Un haz de electrones penetra en la muestra congelada y la interacción de los electrones con el material crea una imagen."
Los investigadores toman muchas imágenes individuales, las procesan y las combinan computacionalmente para obtener estructuras de proteínas en 3D de alta resolución. De esta forma, pudieron descifrar las estructuras de FLVCR1 y FLVCR2 y ver cómo cambian en presencia de etanolamina y colina. Las simulaciones por computadora confirmaron y visualizaron cómo las proteínas FLVCR interactúan con la etanolamina y la colina, y cambian dinámicamente su estructura para permitir el transporte de nutrientes.
Safarian resume:"Nuestros hallazgos allanan el camino para comprender el desarrollo y la progresión de enfermedades raras asociadas con las proteínas FLVCR. En el futuro, los pacientes podrán beneficiarse de nuevas terapias que restablezcan su calidad de vida".
Más información: Keiken Ri et al, Mecanismo molecular del transporte de colina y etanolamina en humanos, Naturaleza (2024). DOI:10.1038/s41586-024-07444-7
Información de la revista: Naturaleza
Proporcionado por la Sociedad Max Planck