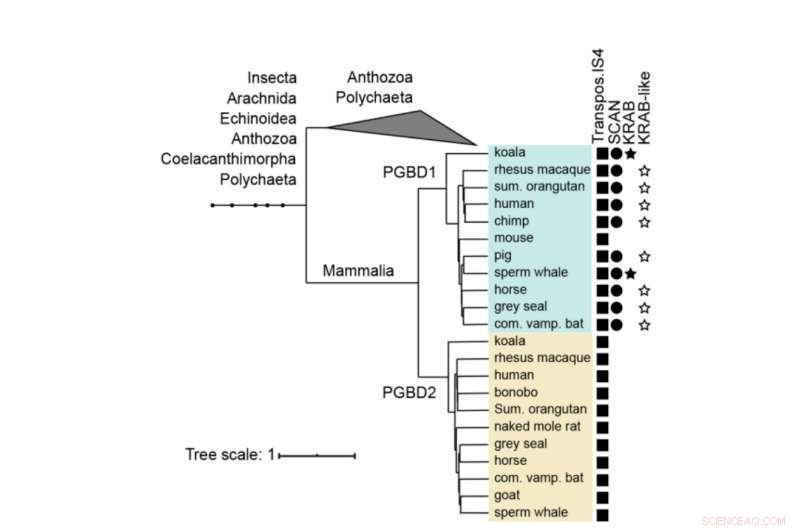
Árbol filogenético de PGBD1 y PGBD2. Se muestra la presencia de los dominios SCAN y KRAB derivados de la transposasa. El PGBD1 y PGBD2 humanos, con las secuencias más estrechamente relacionadas (que contienen transposasa IS4) se alinearon con músculo y se construyó un árbol usando MrBayes. Los dominios de proteínas se anotaron con hmmerscan y CDD (NCBI). El dominio KRAB se anotó con Phyre2. Crédito:Biología Molecular y Evolución (2022). DOI:10.1093/molbev/msac175
La evolución a menudo se presenta como un proceso de "retoques", que hace uso de ligeras modificaciones a las capacidades preexistentes. Entonces, ¿cómo desarrollan los organismos nuevas estructuras?
Un nuevo estudio realizado por la Dra. Zsuzsanna Izsvák del Centro Max Delbrück de Medicina Molecular de la Asociación Helmholtz (Centro Max Delbrück) y el Profesor Laurence Hurst del Centro Milner para la Evolución de la Universidad de Bath (Reino Unido) encontró evidencia de que la evolución de un nuevo gen sustenta la evolución de una nueva estructura que se encuentra en las células nerviosas. Describen este gen inusual llamado piggyBac Transposable Element-derived 1, o PGBD1, en la revista Molecular Biology and Evolution .
Los 'genes saltadores' causan mutaciones
PGBD1 es uno de los cinco genes PGBD relacionados que muestra una clara semejanza con el elemento piggyBac identificado por primera vez en los insectos, de ahí el nombre derivado del elemento transponible piggyBac. Los elementos PiggyBac son "genes saltadores", también llamados transposones. Son capaces de copiarse a sí mismos y moverse de un lugar a otro en el genoma, a veces introduciendo mutaciones o cambiando funciones. Los transposones PiggyBac llegaron a nuestra especie por transferencia horizontal, similar a cómo algunos virus pueden integrar su genoma en nuestro ADN.
Sin embargo, mientras que los transposones piggyBac han perdido su capacidad de moverse en nuestro ADN con el tiempo, cinco genes derivados del elemento transponible piggyBac (PGBD1-5) se han fijado en humanos. "Nuestro objetivo era descubrir qué función potencialmente útil podrían tener los genes PGBD", dice Zsuzsanna Izsvák. "Para este estudio, nos enfocamos en PGBD1".
Entre los cinco genes PGBD, PGBD1 es único porque también ha incorporado partes de otros genes, lo que da como resultado una proteína que tiene partes adicionales que pueden unirse a otras proteínas y al ADN. PGBD1 es, por lo tanto, un gen novedoso que es en parte un fragmento de gen humano y en parte un gen saltador inactivo.
PGBD1 regula las células nerviosas y sus 'trampas de proteínas'
PGBD1 se encuentra solo en mamíferos. Es particularmente activo en las células que se convierten en neuronas. Los investigadores investigaron primero dónde se une la proteína PGBD1 al ADN y observaron que se pega dentro y alrededor de los genes asociados con el desarrollo nervioso. Descubrieron que PGBD1 controla el desarrollo de las células nerviosas bloqueando los genes expresados en las células nerviosas maduras mientras mantiene activados los genes asociados con las células prenerviosas. La reducción del nivel de PGBD1 en las células prenerviosas hizo que comenzaran a desarrollarse como células nerviosas.
Uno de los genes a los que se une la proteína PGBD1 atrajo especialmente su interés. NEAT1 es un gen extraño que codifica un ARN que, inusualmente, luego no produce una proteína. En cambio, este producto, un ARN no codificante, constituye la columna vertebral de una estructura física, las parapetas. Estas son pequeñas estructuras en los núcleos de algunas de nuestras células que actúan como trampas para algunos ARN y proteínas.
Los investigadores encontraron que en las células prenerviosas, la proteína PGBD1 se une al gen NEAT1 y evita que funcione. Sin embargo, cuando los niveles de PGBD1 bajan, los niveles de ARN de NEAT1 aumentan, se forman parapetas y las células se convierten en células nerviosas maduras. Por lo tanto, PGBD1 ha evolucionado hasta convertirse en un regulador clave de la presencia o ausencia de paramoteas y, por lo tanto, el regulador del desarrollo de las células nerviosas.
La evolución no es un juego aleatorio
Sin embargo, lo que es más intrigante es que las parapetas, como PGBD1, también son específicas de los mamíferos. PGBD1 es entonces un raro ejemplo de un nuevo gen que ha evolucionado para regular una nueva estructura, aunque bastante pequeña. Zsuzsanna Izsvák, coautora principal del Centro Max Delbrück, dice:"Este es un descubrimiento realmente inusual y fortuito. Sabíamos que la duplicación de genes preexistentes puede sustentar la evolución de la novedad, pero este es un ejemplo raro de evolución haciendo más que solo retocar. Este es un gen novedoso para controlar una estructura novedosa". La pregunta emocionante ahora es si también juega un papel en las neuronas adultas.
El coautor principal, el profesor Laurence Hurst, del Centro Milner para la Evolución de la Universidad de Bath, agrega que "han descubierto cómo se controlan los paraspeckles, ahora solo tenemos que averiguar cómo evolucionó el paraspeckle en sí. Esta podría ser una tarea mucho más difícil". ya que los ARN no codificantes como NEAT1 tienden a evolucionar rápidamente y, por lo tanto, son difíciles de rastrear a lo largo del tiempo evolutivo".
Este acoplamiento entre NEAT1 y PGBD1 también puede estar involucrado en la esquizofrenia. Si bien NEAT1 se ha asociado previamente con esta enfermedad neurológica, el equipo identificó algunas mutaciones en PGBD1 que podrían mostrar que también eran comunes en pacientes con esquizofrenia; una de estas mutaciones cambia la proteína de PGBD1 mientras que otras pueden controlar su nivel.
El primer autor, el Dr. Tamas Raskó, en el momento del estudio investigador postdoctoral en el grupo de Zsuzsanna Izsvák, dice que "seguramente es más que una coincidencia que ambos genes estén involucrados en la esquizofrenia. Es muy inusual encontrar una mutación que cambie un proteína que está acoplada a esta enfermedad. Los efectos de esta mutación deben ser una prioridad para futuros estudios". Los científicos desentrañan el misterio de los genes que son clave para el desarrollo del cerebro