Los medicamentos que contienen oro se han utilizado durante siglos para tratar afecciones como la artritis reumatoide. Además, podrían ser eficaces contra el cáncer y el VIH. Un mecanismo por el cual funcionan podría ocurrir porque los iones de oro fuerzan a los iones de zinc a salir de los dedos de zinc, en forma de bucle, dominios de proteínas de unión a ácidos nucleicos. Investigadores estadounidenses han caracterizado estos "dedos de oro" utilizando espectrometría de masas de movilidad iónica. Como se informó en la revista Angewandte Chemie , identificaron los sitios exactos de unión del oro.
"Los iones de zinc en los dedos de zinc se unen a cuatro átomos de azufre o nitrógeno de los residuos de cisteína e histidina de la proteína, "explica Nicholas P. Farrell de Virginia Commonwealth University (Richmond, ESTADOS UNIDOS). "Los iones de oro se unen a solo dos fragmentos de aminoácidos y cambian la conformación de la proteína. Los" dedos de oro "ya no pueden unirse a los ácidos nucleicos, que puede ser terapéuticamente útil ".
Aunque existe una variedad de sitios de unión potenciales para los iones metálicos, cada metaloproteína suele preferir una única conformación. Anteriormente no era posible determinar dónde estaban los sitios de unión específicos en una mezcla de confórmeros. Farrell y su equipo han examinado de cerca dos dedos de oro. Según Farrell, "Reemplazar el zinc en el dedo de zinc 3 del factor de transcripción Sp1 conduce a una sola especie de dedo de oro". Los investigadores identificaron esto como un vínculo lineal Cys-Au-His. En el caso de la proteína nucleocápside del VIH, que juega un papel fundamental en la replicación del virus, "poner oro en el dedo de zinc 2 de la proteína (NCp7-F2), conduce a tres especies de dedos de oro diferentes con motivos lineales Cys-Au-Cys, uno de los cuales es claramente predominante ".
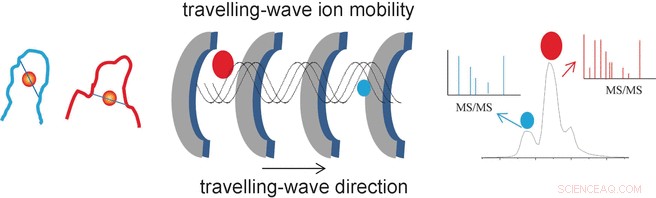
El éxito de los investigadores se debe al uso de un método analítico especial llamado espectrometría de masas de movilidad iónica de ondas viajeras (TWIM-MS). En esta técnica, las moléculas a analizar se ionizan y los iones se aceleran mediante un campo eléctrico en un gas. Las colisiones con las moléculas de gas hacen que los iones se ralenticen. Grande, Las moléculas voluminosas se ralentizan más que las pequeñas, los compactos porque chocan con más frecuencia. Esto también permite diferenciar y separar isómeros, porque aunque tengan la misma masa, sus diferentes geometrías dan como resultado una movilidad diferente. Una vez separados según su movilidad, los iones individuales ahora se pueden fragmentar mediante disociación inducida por colisión (CID) y los fragmentos se pueden medir nuevamente mediante espectrometría de masas. Esto permite caracterizar péptidos más cortos que permanecen unidos al oro.
"De este modo, pudimos identificar los sitios y modos de unión específicos para los dedos de zinc modificados con oro NCp7-F2 y Sp1-F3, "dice Farrell." La espectrometría de masas de movilidad iónica proporciona así información importante sobre los cambios en la geometría causados por el intercambio de zinc en las proteínas con dedos de zinc, así como la selectividad y reactividad de tales reacciones. Esto podría resultar beneficioso en la búsqueda de nuevos fármacos antivirales y antitumorales a base de metales ".