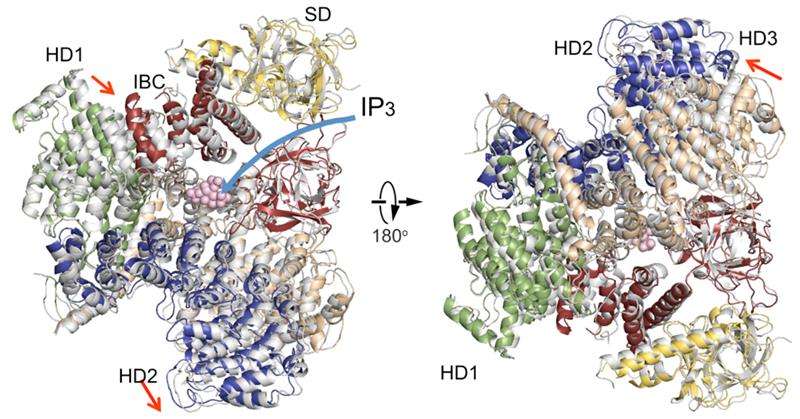
Una comparación de las estructuras del dominio citosólico de IP3R en ausencia de IP3 (en color) con una en presencia de IP3 (gris). Organización del dominio. Dominio supresor (SD), amarillo; Núcleo de enlace IP3 (IBC), rojo; dominio helicoidal 1 (HD1), verde; dominio helicoidal 2 (HD2), azul; dominio helicoidal 3, trigo. Crédito:RIKEN
Los investigadores del RIKEN Brain Science Institute han determinado la estructura de resolución atómica de una molécula clave que traduce las señales del entorno local de una célula a un lenguaje que la célula puede comprender y utilizar. La determinación de la arquitectura del receptor de trisfosfato de inositol (IP3R) se había considerado durante mucho tiempo un objetivo importante en la investigación biomédica debido a su papel estratégico dentro de las células como una estación de tren molecular para transferir señales que controlan muchas funciones celulares.
Culminando un esfuerzo de casi 10 años, Los investigadores han determinado la estructura de resolución atómica de una molécula clave que traduce las señales del entorno local de una célula a un lenguaje que la célula puede comprender y utilizar. La determinación de la arquitectura del receptor de trisfosfato de inositol (IP3R) se había considerado durante mucho tiempo un objetivo importante en la investigación biomédica debido a su papel estratégico dentro de las células como una estación de tren molecular para transferir señales que controlan muchas funciones celulares. Se espera que la estructura contribuya al desarrollo de mejores enfoques terapéuticos para muchas enfermedades. El trabajo fue realizado por un equipo del RIKEN Brain Science Institute bajo la dirección del profesor Katsuhiko Mikoshiba, cuyo laboratorio clonó el primer gen IP3R en 1989.
En todas las células vivas las señales químicas se aprovechan para la comunicación intracelular. El inositol 1, 4, El 5-trifosfato (IP3) es una de esas señales que se une al receptor IP3 (IP3R) para liberar iones de calcio (Ca2 +) de las reservas de Ca2 + intracelulares, como el retículo endoplásmico. Los depósitos de Ca2 + integrados en IP3R se distribuyen en varios microdominios dentro de las células y tienen funciones fundamentales en procesos tan diversos como la comunicación neuronal, diferenciación, plasticidad, y metabolismo. De los tres genes identificados, el cerebro dominante tipo 1 IP3R (IP3R1) es genéticamente causante de ataxia espinocerebelosa 15/16/29 y síndrome de Gillespie, y regula los procesos de eliminación de desechos celulares implicados en la etiología de enfermedades neurodegenerativas, incluida la enfermedad de Alzheimer. Aunque las funciones importantes de IP3R en condiciones normales y patológicas son bien conocidas, comprender cómo las señales IP3 desencadenan la apertura del canal de Ca2 + fue difícil de alcanzar.
La nueva estructura cristalina IP3R1 revela un rico cosmos de detalles a escala atómica sobre su función. IP3R1 es una micromáquina de 20 nm de diámetro que contiene dos subestructuras funcionales, un sitio de unión de IP3 y un poro de canal de Ca2 +. La distancia desde el sitio de unión de IP3 al poro del canal es de 7 nm, el más largo entre los canales iónicos similares, y la cuestión fundamental de cómo la unión de IP3 abre físicamente el canal desde un rango largo no ha sido respondida en las décadas desde que se clonó el gen. Cristalografía de rayos X del gran dominio citosólico de un ratón IP3R1 en ausencia y presencia de IP3, en la fábrica de haces de iones RIKEN SPring-8, identificó un mecanismo de largo alcance que implica un movimiento global dependiente de IP3 de una parte del receptor llamado dominio helicoidal α de curvatura que sirve como puente entre los dominios citosólico y de canal. La mutagénesis de este puente reveló el papel esencial de una estructura de valvas en el dominio α-helicoidal que transmite señales IP3 al canal, y puede ayudar a explicar cómo se produce el acoplamiento de largo alcance desde la unión de IP3 al canal de Ca2 +.
Los hallazgos revelan similitudes y diferencias con un informe publicado recientemente sobre el IP3R que utiliza un método completamente diferente llamado microscopía crioelectrónica. En el estudio relacionado, un grupo liderado por Irina Serysheva del Centro de Ciencias de la Salud de la Universidad de Texas en Houston propuso que la activación del canal por IP3 puede ocurrir mediante la unión directa del terminal C y el dominio de unión a IP3 y el acoplamiento del dominio de unión a IP3 a las subunidades vecinas. Los datos actuales no están de acuerdo con estas conclusiones, en su lugar, sugiere que el sitio de unión de IP3 a la región de la valva subyace a los cambios estructurales dinámicos de IP3. Una comparación de las dos estructuras revela un acuerdo sobre una parte inmóvil del dominio helicoidal de curvatura y una disposición variable de otros dominios helicoidales. Los autores plantean la hipótesis de que la sección inmóvil actuaría como un cuerpo rígido que conduciría un par de torsión desde los sitios de unión de IP3 al dominio del canal, mientras que las regiones flexibles contribuirían a las propiedades dinámicas de la función IP3R.
Resolver el misterio de larga data de la comunicación de largo alcance que permite que IP3 abra el canal ayudará al futuro diseño racional de medicamentos dirigidos al receptor que podría permitir una gama más diversa de vías terapéuticas. Los hallazgos también pueden aclarar los roles de IP3R en la senescencia celular y la supresión de tumores vinculados a la vulnerabilidad selectiva de las células cancerosas. Asombrosamente, el estudio también aclara el papel de los IP3R en la función de organismos unicelulares patógenos como Trypanosoma cruzi, el parásito de la enfermedad de Chagas, y brucei, que causa tripanosomiasis africana o enfermedad del sueño. El equipo identificó una secuencia de aminoácidos en el prospecto que se conserva en parásitos, sugiriendo conocimientos estructurales que pueden ayudar en el descubrimiento de fármacos para estas devastadoras condiciones.