Crédito:Instituto de Investigación Scripps
Cuando se trata de ciertas moléculas, la forma marca la diferencia. La forma del limoneno, por ejemplo, un compuesto producido por frutas cítricas, determina si sabe a zumo de naranja o trementina. En el caso de la terapéutica, la forma tridimensional de una molécula puede ser fundamental para la actividad.
Ahora, Los científicos de Scripps Research y Bristol-Myers Squibb han creado una nueva y poderosa herramienta para controlar con precisión la arquitectura 3-D, también llamada estereoquímica, de enlaces conocidos como tiofosfatos, que se encuentran en algunos fármacos nuevos y prometedores que se dirigen a moléculas genéticas y otros objetivos de enfermedades, según un artículo publicado hoy en Ciencias .
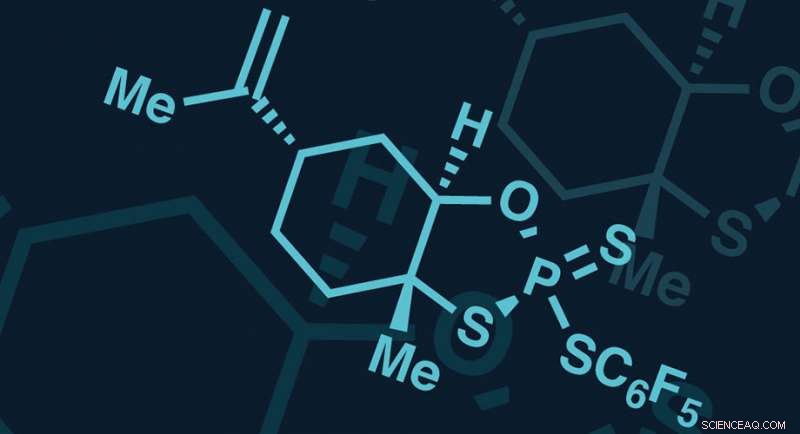
Incorporación de fósforo-azufre (PSI, para abreviar), la primera tecnología de su tipo actúa como una pistola de pegamento atómica, uniendo nucleósidos en oligómeros con especificidad, configuraciones espaciales preprogramadas en el enlace tiofosfato. Los enlaces tiofosfato son análogos del método de la naturaleza para conectar nucleósidos y ofrecen múltiples ventajas para el desarrollo de fármacos. pero agregue la complejidad de la estereoquímica en el átomo de fósforo. PSI proporciona una método sencillo y económico para permitir el desarrollo de isómeros individuales de estos compuestos, que puede tener cientos de miles de estereoisómeros.
"Los compuestos de nucleótidos a base de tiofosfato representan un potencial terapéutico notable, pero nuestra comprensión de estos sistemas se ha visto obstaculizada por la incapacidad de controlar fácilmente la estereoquímica del tiofosfato durante la síntesis de fármacos, "dice Phil Baran, Doctor., un profesor de Scripps Research y científico principal del estudio. "PSI proporciona un método robusto y estéreo controlado para sintetizar fármacos oligonucleotídicos, permitiéndonos crear, analizar y fabricar estereoisómeros de un candidato a fármaco de formas que antes solo eran posibles con métodos costosos e ineficaces ".
Martin Eastgate, Doctor., coautor principal de la Ciencias papel y científico principal del equipo de Bristol-Myers Squibb, dice que al proporcionar un método simple y generalizado para controlar la estereoquímica de los enlaces centrados en fósforo, llamados enlaces tiofosfato, PSI supera un obstáculo importante para descubrir la próxima generación de medicamentos innovadores.
"La invención de estos estereoselectivos, sencillo, Los reactivos escalables y estables proporcionan una solución a este complejo problema, "dice Eastgate, director de grupo y jefe de investigación química en la organización de Desarrollo Químico y Sintético de Bristol-Myers Squibb. "Esperamos que la invención de la clase de reactivos PSI demuestre ser una tecnología habilitadora para la comunidad científica".
Para construir la cadena larga de nucleótidos presentes en los oligonucleótidos, la técnica de fabricación actual se basa en lo antinatural, pero muy reactivo, Estado de oxidación del fósforo (III). Una de las principales limitaciones de la aplicación de la química P (III) estándar a la síntesis de tiofosfato es la falta de control sobre la forma tridimensional del nuevo estereocentro basado en fósforo.
"Usar la química de P (III) para producir incluso una cantidad modesta del compuesto como un solo estereoisómero es un desafío, lo que dificulta la evaluación completa del impacto de la forma molecular en la función biológica, "dice Justine deGruyter, estudiante de posgrado de Scripps Research y uno de los primeros autores en el Ciencias papel. Para superar estas limitaciones, los investigadores de Bristol-Myers Squibb y Scripps exploraron usando una forma diferente de fósforo, P (V), que fue evitado durante mucho tiempo por los químicos sintéticos debido a su baja reactividad. Si bien P (V) es generalmente menos reactivo que P (III), lo que puede dificultar su uso en la construcción de moléculas en el laboratorio, los científicos sospecharon que su estabilidad superior podría traducirse en un control mucho mejor sobre la forma molecular tridimensional durante la síntesis.
En el transcurso de dos años, los equipos de Scripps y Bristol-Myers Squibb colaboraron para desarrollar un método eficaz de utilizar P (V) para producir los estereoisómeros de moléculas deseados. Se centraron en encontrar una forma de unir cadenas de nucleósidos con un reactivo sin rastros que no dejara átomos no deseados. El resultado de esto fue el reactivo PSI.
Los investigadores han utilizado PSI para generar estereoisómeros puros de dinucleótidos cíclicos (CDN), la base de los candidatos a fármacos CDN que han generado mucho entusiasmo como un nuevo tipo de inmunoterapia contra el cáncer. Los medicamentos CDN se dirigen a una proteína llamada STING (estimulador de genes de interferón) para activar el sistema inmunológico del cuerpo contra los cánceres.
"Las CDN son una promesa increíble para activar el sistema inmunológico contra los cánceres, pero hasta ahora no había una forma sencilla de controlar su estereoquímica, "dice Kyle Knouse, estudiante de posgrado en el laboratorio de Baran y primer autor de la Ciencias papel. "La capacidad de crear estereoisómeros puros de manera eficiente y económica proporcionará una herramienta poderosa para avanzar en la investigación de CDN".
En el caso de las CDN, y medicamentos ASO, la capacidad de preparar un solo estereoisómero permitirá a los científicos explorar qué formas de los fármacos son más eficaces desde el punto de vista terapéutico y generar esos estereoisómeros para uso clínico. Otra ventaja de PSI es que no tiene trazas, evitando así el tiempo y el coste de tener que eliminarlo del medicamento durante la fabricación.
Los investigadores de Bristol-Myers Squibb y Scripps están entusiasmados de continuar explorando otras formas de usar estos reactivos para construir moléculas complejas.