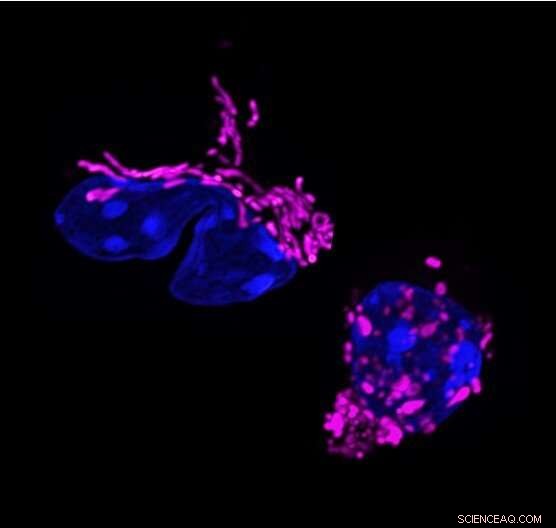
Cambio de forma mitocondrial en la respuesta de las células T. Los cambios dinámicos en la forma mitocondrial se vinculan con la función de las células T. Las células T colaboradoras 17 muestran mitocondrias alargadas (de color púrpura, izquierda). La eliminación de la proteína OPA1 que forma la membrana mitocondrial, fragmenta las mitocondrias en las células T (derecha) y altera la respuesta de las células T. Crédito:Francesc Baixauli
Un nuevo estudio centrado en las células Th17 del sistema inmunitario sugiere que la forma y la función de sus mitocondrias son importantes en los trastornos autoinmunitarios e inflamatorios, como la esclerosis múltiple. Las células T auxiliares 17 (Th17) son un tipo de células inmunitarias T CD4+, que colectivamente ayudan a producir anticuerpos, activan las células devoradoras de enemigos y reclutan más soldados para el frente de batalla.
La investigación, dirigida por Erika Pearce, Ph.D., del Instituto Bloomberg~Kimmel para la Inmunoterapia del Cáncer en el Centro de Cáncer Johns Hopkins Kimmel, sugiere que aprender cómo las mitocondrias impactan en las células Th17 es clave para entender cómo controlarlas.
El estudio, publicado el 28 de septiembre en la revista Nature , identifica varias vías para tratar de influir en el comportamiento de estas importantes células, con el objetivo de amortiguar su actividad autoinmune.
Cuando una célula T se expone por primera vez a un enemigo, responde a las señales del enemigo y del medio ambiente para convertirse en uno de varios tipos de células T especializadas, cada una armada con funciones distintas en la respuesta inmune. Si bien todos los subtipos de células T auxiliares son cruciales para la lucha del cuerpo contra los extraños, su desequilibrio también puede causar enfermedades, como diabetes tipo 1, asma, alergias e inflamación crónica.
"Si pudiéramos controlar las células T, podría decirse que podríamos controlar muchas infecciones, autoinmunidad y cánceres, si no la mayoría", dice Pearce, autor principal del estudio y profesor distinguido de Johns Hopkins Bloomberg en el Departamento de Oncología y el Departamento de Bioquímica y Biología Molecular.
El estudio comenzó cuando los investigadores del laboratorio de Pearce, que entonces estaba en el Instituto Max Planck en Freiburg, Alemania, notaron un rasgo peculiar de las células Th17. Entre los tres tipos principales de células T efectoras, solo las células Th17 tenían mitocondrias alargadas; es decir, sus centrales eléctricas internas se fusionaron en estructuras más grandes. "Eso fue extraño porque las mitocondrias alargadas generalmente se ven en las células en reposo y no en las células activadas", dice el primer autor Francesc Baixauli, Ph.D., ex becario postdoctoral en el Instituto Max Planck.
Los investigadores sabían que el gen OPA1 regula la fusión mitocondrial, por lo que lo eliminaron en las células Th17 y descubrieron que sus mitocondrias volvían a tener un tamaño y una forma más fragmentados. Sin embargo, las células también dejaron de hacer su trabajo principal:producir la molécula de señalización interleucina-17 (IL-17).
Para confirmar este resultado en un organismo, los investigadores eliminaron el gen OPA1 en ratones y promovieron una enfermedad en estos animales que modela la esclerosis múltiple humana, que es impulsada por sus células Th17. Con la eliminación de OPA1, sus células no solo dejaron de producir IL-17, sino que también disminuyeron los síntomas de la enfermedad.
Al preguntarse cómo la eliminación de OPA1 detuvo la producción de IL-17, el equipo primero pensó que las mitocondrias de las células simplemente no estaban produciendo suficiente energía. Sin embargo, encontraron que la eliminación de OPA1 no afectaba la producción de energía y que OPA1 era crucial para la producción de IL-17, independientemente de si la actividad metabólica de las células era alta o baja. Luego, encontraron que un proceso bioquímico central que ocurre en las mitocondrias se había alterado, causando la acumulación de un metabolito que se sabe que influye en el ADN y el programa transcripcional de la célula. "Esa molécula estaba amortiguando la capacidad de la célula para leer su ADN y, en consecuencia, ya no se producía IL-17", dice Baixauli.
Para identificar la conexión entre estas respuestas y la eliminación de OPA1, los investigadores compararon las proteínas producidas por las células Th17 normales y aquellas sin OPA1. En las células a las que les faltaba OPA1, encontraron un gran aumento en la forma activada de la proteína LKB1, que es un sensor metabólico que regula el metabolismo celular, la división celular y la función mitocondrial. Cuando eliminaron OPA1 y LKB1 de las células, se restauró la producción de IL-17 y los procesos mitocondriales volvieron a la normalidad.
"Creemos que LKB1 detecta el estrés mitocondrial y altera adecuadamente las reacciones bioquímicas de las mitocondrias, lo que afecta la producción de IL-17", dice Pearce. "Ahora tenemos una lista corta de moléculas que se sabe que influyen en este aspecto clave de la función Th17, que puede ser el punto de inflexión entre sus funciones beneficiosas y perjudiciales. Nuestra investigación futura continuará explorando estas relaciones para que, con suerte, algún día podamos modificar terapéuticamente a ellos." Un estudio revela el papel protagónico de las mitocondrias que cambian de forma en la función de las células madre