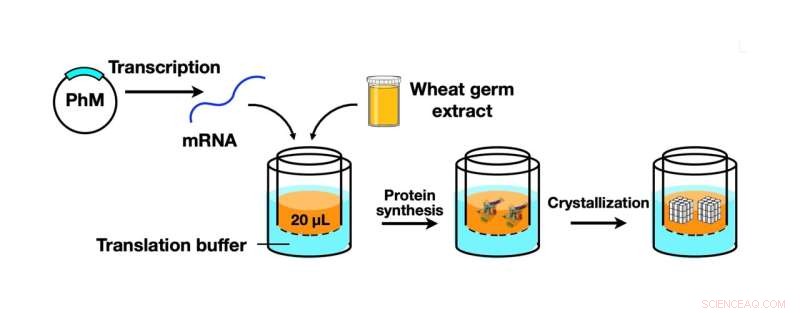
Ilustración esquemática del proceso CFPC utilizando un kit de síntesis de proteína de germen de trigo para sintetizar monómero de poliedrina (PhM) que luego se cristalizó en cristales de poliedros de tamaño nanométrico. Crédito:Prof. Takafumi Ueno
El nuevo método de cristalización de proteínas sin células (CFPC) desarrollado por Tokyo Tech incluye la cristalización directa de proteínas y es un gran avance en el campo de la biología estructural. Esta técnica permitirá el análisis de proteínas inestables que no podrían estudiarse con métodos convencionales. Analizarlos aumentará nuestro conocimiento de los procesos y funciones celulares.
Si bien estamos familiarizados con ciertos cristales como la sal y el azúcar que usamos en nuestra vida cotidiana, hay otro conjunto de cristales, ocultos a simple vista, que son cruciales para nuestra biología. Los cristales microscópicos de proteína se encuentran en las células vivas y ayudan a mantener procesos como la activación del sistema inmunitario, el almacenamiento y la protección de proteínas.
Para comprender mejor la relación entre la estructura y la función de los cristales de proteínas, los científicos desarrollaron el método de cristalización de proteínas en la célula (ICPC), que puede observar directamente los cristales de proteínas en las células vivas, lo que garantiza cristales de alta calidad sin necesidad de procesos de purificación o exámenes complejos. métodos. Sin embargo, a pesar de sus muchas ventajas, se informaron muy pocas estructuras porque los cristales formados en las células vivas no tenían el tamaño y la calidad que se requería para el análisis. Entonces, un equipo de investigadores de Japón, dirigido por el profesor Takafumi Ueno de Tokyo Tech, se propuso desarrollar un método mejor. Y recientemente, lograron un gran avance.
En su artículo publicado en Scientific Reports , el equipo informó sobre el desarrollo de una técnica que haría que la cristalización y el análisis de proteínas fueran más eficientes y efectivos. Esta técnica, un método de cristalización de proteínas sin células (CFPC), era un híbrido entre la cristalización de proteínas in vitro y la ICPC, y permitía la formación rápida y directa de cristales de proteínas sin necesidad de métodos complicados de cristalización y purificación.
Las imágenes de microscopía electrónica de barrido y los histogramas de distribución de tamaño de los cristales de poliedros (PhC) muestran varios puntos en el proceso CFPC dependiente del tiempo. Crédito:Prof. Takafumi Ueno
Volviendo al equipo que realiza el estudio actual (algunos de los cuales también son miembros del Laboratorio Ueno), utilizaron un kit de síntesis de proteína de germen de trigo, que es una herramienta para la síntesis de monómero de poliedrina, una proteína viral producida en células de insectos por infección por citovirus. Luego, esta proteína se cristalizó utilizando el nuevo método CFPC, lo que condujo a la formación de cristales de poliedros de tamaño nanométrico (PhC). El equipo pudo completar este proceso de manera eficiente en seis horas, utilizando solo 20 microlitros de la mezcla de reacción.
Las imágenes de microscopía electrónica de barrido indicaron que los PhC tenían una pureza excelente, lo que permitió la determinación de su estructura a una resolución de hasta 1,95 Å (o 1,95 angstrom). Para explorar más a fondo las capacidades de su nuevo sistema, el equipo llevó a cabo el análisis estructural de la proteína de inclusión cristalina A (CipA). Su estructura se determinó a una alta resolución de 2,11 Å, algo que nunca se había informado antes de este estudio.
Este trabajo es un gran avance en el campo de la biología estructural, ya que el método que propone permitirá el análisis de proteínas inestables y de bajo rendimiento que no pueden estudiarse mediante métodos convencionales. Esta tecnología también tiene como objetivo ayudar en el desarrollo de técnicas avanzadas para la cristalización y el análisis de proteínas a pequeña escala y rápidos. "Los cristales de proteína de alta calidad producidos por nuestro método ampliarán los horizontes de la determinación estructural y nos brindarán información útil y sin precedentes sobre el complejo entorno de las células vivas", dice el profesor Ueno. Impresora nano-3D en la célula:Sintetización de filamentos estables a partir de cristales de proteína en la célula