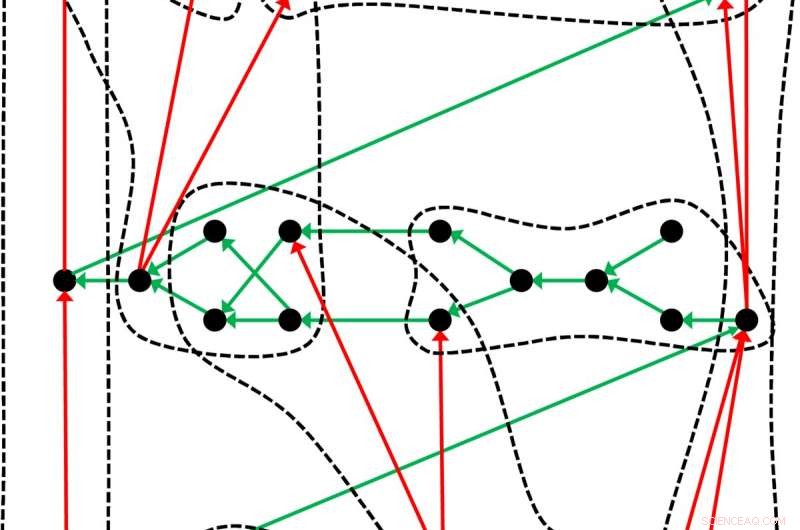
Una tabla periódica ligeramente diferente:la tabla de elementos químicos, que se remonta a Dmitri Mendeleev y Lothar Meyer, es solo un ejemplo de cómo los objetos, en este caso los elementos químicos, pueden organizarse en un sistema de este tipo. Los investigadores de Leipzig ilustran la estructura general de una tabla periódica con este ejemplo:Los puntos negros representan los objetos ordenados por las flechas verdes. Utilizando un criterio adecuado, los objetos se pueden clasificar en grupos (líneas discontinuas) en los que las flechas rojas crean un suborden. Crédito:Guillermo Restrepo, MPI de Matemáticas en las Ciencias
La tabla periódica de elementos que describen la mayoría de los libros de química es solo un caso especial. Esta descripción tabular de los elementos químicos, que se remonta a Dmitri Mendeleev y Lothar Meyer y los enfoques de otros químicos para organizar los elementos, implican diferentes formas de representación de una estructura oculta de los elementos químicos. Esta es la conclusión a la que llegaron investigadores del Instituto Max Planck de Matemáticas en las Ciencias de Leipzig y de la Universidad de Leipzig en un artículo reciente. El enfoque matemático de los científicos de Leipzig es muy general y puede proporcionar muchos sistemas periódicos diferentes según el principio de orden y clasificación, no solo para la química, pero también para muchos otros campos del conocimiento.
Es un icono de las ciencias naturales y se cuelga en la mayoría de las aulas de química:la tabla periódica de elementos, que este año celebra su 150 aniversario. El resumen tabular está estrechamente relacionado con Dmitri Mendeleev y Lothar Meyer, dos investigadores que, en la década de 1860, creó una disposición de elementos basada en sus masas atómicas y similitudes. Hoy en día están ordenados por número atómico (que indica el número de protones en el núcleo atómico) desde el hidrógeno ligero (un protón) hasta el oganesson sintético (118 protones). Los elementos también se clasifican en grupos:los átomos de la misma columna suelen tener el mismo número de electrones en su capa exterior.
Tabla periódica en diferentes variantes.
A primera vista, la tabla periódica parece haber traído un orden definitivo e inequívoco a los 118 elementos actualmente conocidos. Pero las apariencias pueden ser engañosas porque muchas cosas siguen siendo controvertidas:los científicos no se ponen de acuerdo sobre qué elementos pertenecen exactamente al tercer grupo por debajo del escandio y el itrio. Por ejemplo, Se debate la posición correcta del lantano y el actinio. Si uno mira más de cerca, uno descubrirá variantes ligeramente diferentes de la tabla periódica en las aulas, Salon de lectura, y libros de texto.
Guillermo Restrepo y Wilmer Leal del Instituto Max Planck de Matemáticas en las Ciencias y la Universidad de Leipzig no se sorprenden. Para ellos, no hay una disposición inequívocamente correcta de los elementos; según el criterio aplicado para la clasificación, resulta una tabla periódica diferente. Los átomos se pueden subdividir de acuerdo con la configuración electrónica (es decir, el número y la disposición de sus electrones), su comportamiento químico, su solubilidad, o su aparición en depósitos geológicos. Actualmente se acepta ampliamente que los elementos químicos deben organizarse según su número atómico y dividirse en grupos según su configuración electrónica. Pero incluso para esta tabla periódica, Existen numerosas formas diferentes de representación. Por ejemplo:como una espiral con varios abultamientos, en forma de pirámide, o como una flor tridimensional.
Una estructura común detrás de las tablas periódicas.
Guillermo Restrepo y Wilmer Leal ahora han investigado sistemáticamente la ambigüedad de la tabla periódica. Esto ha llevado a hallazgos que también son de considerable importancia más allá de la química. Respectivamente, todas las formas de representación de los elementos químicos se basan en una estructura común, que los matemáticos denominan hipergrafo ordenado. La venerable tabla periódica de Mendeleev y Meyer ofrece solo una representación de la estructura general, que ahora postulan Guillermo Restrepo y Wilmer Leal. También se pueden derivar nuevos arreglos de esto en cualquier momento. Guillermo Restrepo, por tanto, compara el orden de los elementos químicos con una escultura sobre la que la luz cae de distintas direcciones. "Las diversas sombras que arroja la figura son las tablas periódicas. Por eso hay tantas formas de crear estas tablas. En cierto modo, las tablas de períodos son proyecciones. Proyecciones de la estructura interna de la tabla periódica ".
Los científicos de Leipzig ahora están tratando de determinar la estructura matemática oculta en la que se basan las tablas periódicas conocidas de la química. Siendo por el momento, han definido tres condiciones que deben cumplirse para poder establecer una tabla periódica. Primero, se necesitan objetos para ordenar. Para Mendeleev, Meyer y los creadores de las otras tablas periódicas conocidas de química, estos son los elementos químicos. These objects must be arranged according to some properties such as the atomic mass or the atomic number (i.e. the number of protons). Finalmente, one criterion is required to group the objects in classes. Mendeleev and Meyer used the chemical similarity for this.

A periodic table of chemical bonds:Each of the 94 circles with chemical element symbols represents the bond that the respective element forms with an organic residue. The bonds are ordered according to how strongly they are polarized. Where there is a direct arrow connection, the order is clear:Bonds of hydrogen, por ejemplo, are more polarized than bonds of boron, fósforo, and palladium. The same applies to rubidium in comparison to caesium, which has particularly low polarized bonds and is therefore at the bottom of the new periodic table. If there is no direct arrow between two elements, they may still be comparable – if there is a chain of arrows between them. Por ejemplo, the bonds of oxygen are more polarized than the bonds of bromine. Bonds represented by the same colour have the same binding behaviour and belong to one of the 44 classes. Credit:Guillermo Restrepo, MPI for Mathematics in the Sciences
Periodic table of chemical bonds
"If these three conditions are met, periodic tables can also be created for other chemical objects and even for objects outside chemistry, " says Guillermo Restrepo. He and Wilmer Leal show this by looking at the chemical bonds between atoms of 94 elements and different conjugates. The polarizability of 94 single-covalent bonds, where bonds are arranged according to the electronegativity and atomic radius of one of the bonded atoms. Por ejemplo, flúor, cloro, or oxygen are highly electronegative and assume relatively small atomic radii in compounds. The bonds are then classified based on how much they resemble each other.
"We have investigated almost 5, 000 substances consisting of two elements in different proportions, " explains Guillermo Restrepo. "We then looked for similarities within this data. Por ejemplo, sodium and lithium are similar because they combine with the same elements in the same proportions (e.g. with oxygen or chlorine, bromo, and iodine). We thus found patterns we can use to classify the elements."
A periodic table as a network instead of a matrix
In the 44 classes of chemical elements, there are some similarities with the main groups of Mendeleev's and Meyer's periodic table. Por ejemplo, the alkali metals sodium and lithium are found in one group because they form the same simple salts with halogens such as chlorine or fluorine. Like the elements themselves, the bonds of the four halogens (fluorine, chlorine bromine, and iodine) are also found in the same group. Sin embargo, there are also classifications that differ significantly from those in the conventional periodic table. Por ejemplo, carbon and silicon are no longer in the same class because they form very different compounds.
The representation of the periodic table of chemical bonds also has nothing to do with the familiar matrix-like arrangement of the classical periodic tables of the elements. En lugar de, the 94 covalent bonds are represented in a network of differently colored circles. Each circle represents a chemical bond, and the colou symbolizes belonging to one of the 44 groups. Because now two criteria are used for the sorting, there is no longer any clear order of the atoms (like in the tables of Mendeleev and Meyer)—mathematicians speak of a partial order. The circles are therefore connected to other circles by one or more arrows, thereby creating an ordered hypergraph.
Periodic tables in other scientific fields
The chemical elements and their compounds can also be represented in completely different periodic tables—depending on the underlying order and classification principle. What's more:The objects of numerous other scientific fields and their applications can also be arranged in periodic tables. Por ejemplo, ordered hypergraphs are used in information systems and web mining. Possible periodic systems also emerge when countries are considered; these can be classified according to social or economic indicators as well as geographical proximity or cultural similarity. Other examples can be found in engineering, environmental sciences, sociología, and many other disciplines. The scientists not only study periodic systems because of their importance for chemistry, pero, sobre todo, because of their applications in many other disciplines.