Mejorar el desarrollo de fármacos para enfermedades potencialmente mortales como el cáncer depende de un conocimiento profundo de las proteínas quinasas, lo que las convierte en un punto focal para los investigadores. Estas enzimas, codificadas por más de 500 genes humanos, desempeñan un papel fundamental en las vías de señalización celular.
Sin embargo, si estas señales no están reguladas, pueden alterar los mecanismos celulares normales y provocar enfermedades como el cáncer. Por lo tanto, los inhibidores de la proteína quinasa han proporcionado una vía prometedora en la intervención terapéutica para alterar los mecanismos de señalización aberrantes que subyacen a dichas enfermedades.
Debido a la similitud y complejidad de las estructuras de las quinasas, el desarrollo de inhibidores de quinasas eficaces ha presentado hasta ahora un desafío formidable para los investigadores. Encontrar inhibidores específicos entre varios objetivos potenciales ha sido un obstáculo hasta ahora.
Un equipo dirigido por el profesor Hiroshi Tokumitsu de la Escuela de Graduados en Ciencias e Ingeniería Interdisciplinarias en Sistemas de Salud de la Universidad de Okayama, junto con la estudiante de posgrado, la Sra. Akari Yoshida y el Dr. Satomi Ohtsuka de la Universidad de Okayama, con el profesor Ulf J. Nilsson de la Universidad de Lund y El profesor Teruhiko Ishikawa de la Escuela de Graduados en Educación de la Universidad de Okayama, publicó un estudio en Scientific Reports el 20 de marzo de 2024. El estudio arroja luz sobre un nuevo inhibidor dirigido a la proteína quinasa 1 asociada a la proteína adaptadora 2 (AAK1).
Hablando de la inspiración, el profesor Tokumitsu afirma:"A través de años de investigación dedicada a los mecanismos de señalización intracelular, hemos creado inhibidores de la proteína quinasa como potentes instrumentos analíticos para las ciencias biológicas fundamentales". Y ahora llegó el momento de ver sus logros en acción."
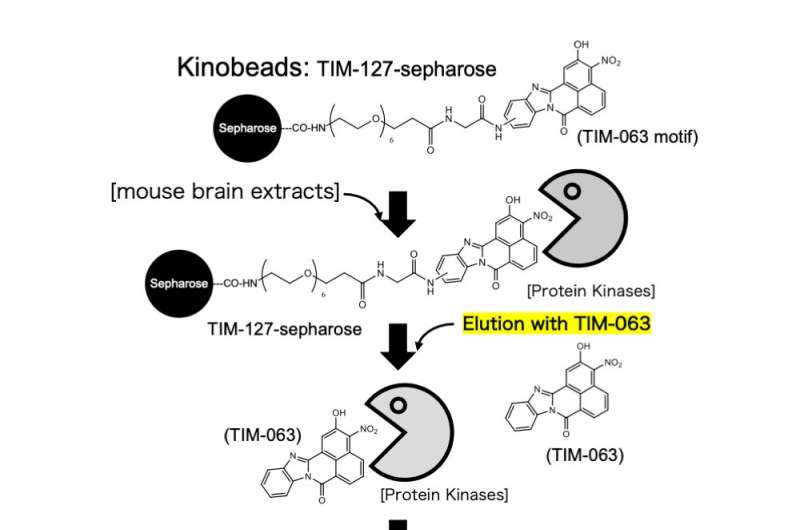
Su estudio introdujo un método innovador que utiliza la tecnología Kinobeads. Este enfoque de vanguardia permitió al equipo explorar las interacciones entre TIM-063, originalmente formulado como Ca 2+ / inhibidor de la proteína quinasa quinasa dependiente de calmodulina (CaMKK) y numerosas proteínas quinasas, con especial atención a AAK1. Mediante la inmovilización en perlas de sefarosa, se crearon complejos TIM-063-sefarosa para capturar selectivamente las quinasas objetivo de extractos celulares.
Después de un lavado extenso para eliminar proteínas no específicas, las quinasas unidas se eluyeron y se identificaron mediante espectrometría de masas. Este enfoque meticuloso arrojó luz sobre la unión de TIM-063 al dominio catalítico de AAK1, ofreciendo información sobre su mecanismo inhibidor. Al dilucidar la unión de TIM-063 al dominio catalítico de AAK1, los investigadores establecieron una base para la inhibición dirigida.
"Nuestra investigación destaca el potencial de reutilizar los inhibidores de quinasa existentes como compuestos líderes para nuevos objetivos terapéuticos", afirma el profesor Tokumitsu.
"Aprovechar los métodos de desarrollo de inhibidores de quinasa, comenzando con la identificación de enzimas que interactúan con los inhibidores existentes, promete un ciclo rápido de descubrimiento de fármacos con proteínas quinasas como objetivo molecular".
El enfoque del estudio en AAK1, asociado con diversos trastornos neurológicos e infecciones virales, destaca la promesa de inhibidores dirigidos. Estos hallazgos abren las puertas al desarrollo de fármacos innovadores, particularmente para abordar necesidades médicas no cubiertas en afecciones como la esquizofrenia, la enfermedad de Parkinson y las infecciones virales.
"En la era del descubrimiento de fármacos, costoso y que requiere mucho tiempo, nuestra investigación puede contribuir significativamente al facilitar el desarrollo de inhibidores enzimáticos rápidos y rentables con aplicaciones clínicas", afirma el profesor Tokumitsu.
Este avance tiene el potencial de revolucionar el descubrimiento de fármacos, ofreciendo un enfoque más ágil para desarrollar inhibidores enzimáticos con aplicaciones clínicas reales. Con este avance, los investigadores pretenden abordar desafíos críticos de atención médica y mejorar el bienestar del paciente.
Más información: Akari Yoshida et al, Desarrollo de un nuevo inhibidor de AAK1 mediante detección basada en Kinobeads, Scientific Reports (2024). DOI:10.1038/s41598-024-57051-9
Información de la revista: Informes científicos
Proporcionado por la Universidad de Okayama