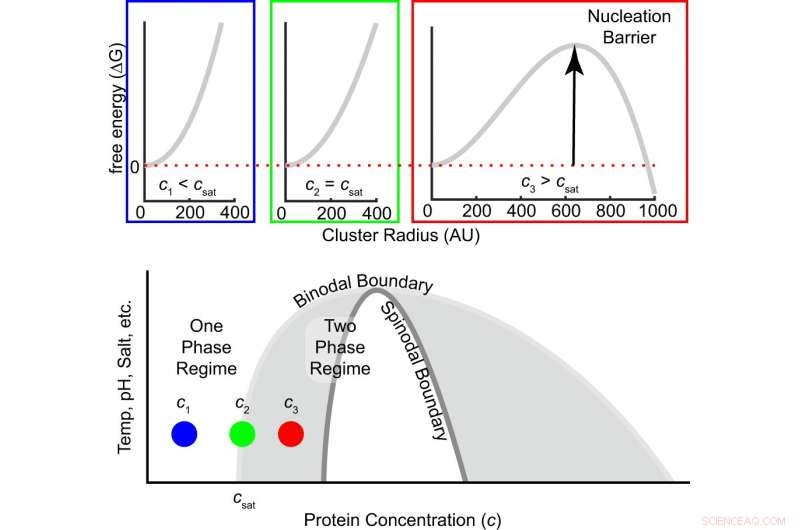
Fig. 1:La barrera de energía libre para la nucleación depende del grado de sobresaturación. La energía libre en función del tamaño del grupo se muestra en la parte superior para tres concentraciones, es decir., debajo, en y por encima de la concentración de saturación. A medida que la concentración aumenta de subsaturado a saturado a sobresaturado, el signo de la diferencia de energía libre entre una molécula dentro y fuera de un grupo cambia de positivo a negativo, y emerge una barrera de nucleación finita (Ec. (1)). La región gris dentro del binodal es metaestable, lo que significa que se requiere la nucleación para formar grupos de fase densos que crecen hasta que se alcanza el equilibrio. El régimen blanco dentro del espinodal es inestable, lo que significa que la solución se descompone espontáneamente en fases diluidas y densas. Crédito:DOI:10.1038 / s41467-021-24727-z
Los científicos del St. Jude Children's Research Hospital están estudiando la separación de fases líquido-líquido (LLPS), proceso biofísico mediante el cual las proteínas y los ácidos nucleicos de una célula se compartimentan sin una membrana. El trabajo proporciona una nueva perspectiva sobre cómo la fuerza de las fuerzas que impulsan la separación de fases está relacionada con la velocidad a la que ocurre. Los hallazgos fueron publicados hoy en Comunicaciones de la naturaleza .
Las células necesitan clasificar y organizar proteínas y otros componentes. Una forma de hacerlo es a través de LLPS, un proceso similar a la forma en que el aceite forma gotitas en el agua. Orgánulos sin membrana, cuerpos en una célula que se comportan como gotas de líquido, organizar ciertas proteínas sin encerrarlas con una membrana. En lugar de, las proteínas se mantienen unidas por las fuerzas biofísicas que impulsan LLPS.
Poco se sabe sobre cómo las biomoléculas pasan de una solución de una fase a una mezcla de dos fases, en un proceso llamado nucleación. Este proceso ha sido difícil de evaluar porque requiere mirar escalas de tiempo extremadamente rápidas (microsegundos a milisegundos). Como resultado, la mayoría de los estudios han analizado en cambio la evolución dentro de sistemas que ya están en el régimen de dos fases (cómo las gotas se fusionan y crecen).
"Podemos ver durante estos puntos de tiempo muy tempranos que incluso las moléculas de proteína desordenadas individuales que se separan en fase tienen propiedades bastante diferentes a las proteínas desordenadas que no se separan en fases, "dijo la coautora correspondiente Tanja Mittag, Doctor., Departamento de Biología Estructural de St. Jude.
La investigación en St. Jude y en otros lugares ha demostrado que LLPS puede participar en enfermedades neurodegenerativas como la esclerosis lateral amiotrófica (ELA) y el cáncer. Una mejor comprensión de LLPS puede, en última instancia, conducir a oportunidades para apuntar terapéuticamente a partes del proceso.
Las mediciones de microsegundos brindan una nueva comprensión
La opinión predominante de LLPS en biología ha sido que un cambio en las condiciones celulares puede conducir espontáneamente a la nucleación, cambiar una solución monofásica en dos fases. En esta investigación, los científicos utilizaron un sistema simplificado, con una sola proteína en agua y sal, para estudiar si el cambio realmente ocurrió de esa manera o si se requieren pasos adicionales para iniciar el proceso.
Con una técnica llamada mezcla rápida, resuelto en el tiempo, dispersión de rayos X de ángulo pequeño (TR-SAXS), los investigadores pudieron observar las primeras etapas del proceso. Examinaron la nucleación de un dominio similar a un prión llamado A1-LCD de la proteína hnRNPA1. Las mutaciones de esta proteína causan ELA y otras enfermedades.
Los científicos mostraron cómo se forman grupos de A1-LCD, y cómo estos grupos conducen a LLPS. Los hallazgos indican que la nucleación contiene distintos pasos, diferenciados por el tamaño del clúster. Al observar los grupos más pequeños (con pocas moléculas individuales), Los científicos encontraron que el comportamiento de ensamblaje difería de la teoría clásica de nucleación. Estas desviaciones explican potencialmente por qué la separación de fases de algunas biomoléculas puede ocurrir en milisegundos, mientras que para otras toma horas.
"Incluso en un sistema simplificado, todavía hay que tener en cuenta este tipo de efectos no ideales en las primeras etapas de la nucleación, "dijo el coautor para correspondencia Erik Martin, Doctor., Departamento de Biología Estructural de St. Jude. "Antes de que pueda comenzar a pensar en el ensamblaje de separación de fases o la condensación en las celdas, necesitas pensar en las cosas desde un nivel molecular. Habrá pasos iniciales para ese ensamblaje que no se tienen en cuenta en modelos anteriores ".