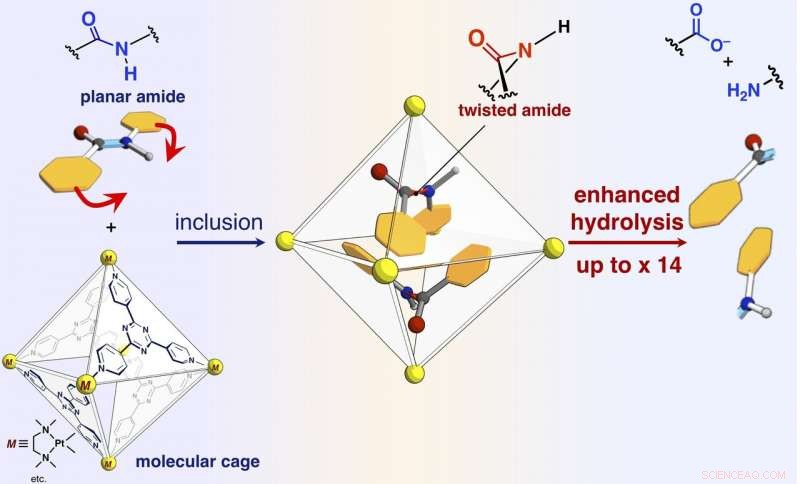
Un esquema de aceleración de la velocidad de reacción de la hidrólisis de amida por inclusión en la jaula molecular autoensamblada. Crédito:NINS / IMS
Las proteínas están compuestas por aminoácidos conectados por enlaces amida. El enlace amida exhibe una alta estabilidad química y tiene una estructura plana alrededor del enlace. Aunque la alta estabilidad del enlace amida es indispensable para mantener las funciones de las proteínas, es problemático convertir el bloque de construcción en alguna otra especie molecular mediante la disociación selectiva de un enlace amida relevante.
Ha habido intentos de controlar la reactividad de un enlace amida específico mediante torsión selectiva mediante complicadas modificaciones químicas. Algunos compuestos modelo con enlaces amida trenzados se han producido mediante síntesis orgánica de varios pasos, y se ha demostrado su alta reactividad. Se presume que la alta reactividad de estos enlaces amida retorcidos también se usa in vivo. Algunas proteínas parecen escindirse selectivamente retorciendo enlaces amida específicos durante la autólisis y el empalme. Estas proteínas, a diferencia de los compuestos modelo sintetizados artificialmente, se supone que utilizan interacciones no covalentes para torcer sus enlaces amida. Durante muchos años, Investigadores de la Universidad de Tokio y el Instituto de Ciencias Moleculares han fabricado jaulas moleculares que se autoensamblan mediante interacciones no covalentes. Aplicaron sus jaulas moleculares para confinar moléculas de amida, que pueden considerarse análogos de pequeños trozos de proteínas, y apretó los enlaces amida presionándolos dentro de su jaula.
Los investigadores han informado en el presente artículo que los enlaces amida, que tienen estructuras planas y son inertes en el espacio libre, se puede torcer, y los compuestos de amida se pueden activar confinándolos en su jaula molecular (que se muestra en la figura). Cuando los compuestos de amida diana y la jaula molecular se mezclan y calientan en una solución acuosa, la jaula confina los compuestos de amida. El análisis de la estructura de rayos X de cristal único reveló que dos compuestos de amida con estructuras retorcidas están confinados en la jaula. Se encontró que el ángulo de torsión alrededor de los enlaces amida alcanzaba los 34 grados. La velocidad de reacción de hidrólisis del objetivo retorcido se aceleró en un factor de cinco. Los investigadores lograron crear una nueva enzima artificial de un mecanismo previamente inexplorado que confina y retuerce las moléculas objetivo para activar un enlace químico específico.
Los investigadores también lograron alterar la reactividad de las moléculas objetivo al confinar "moléculas de relleno, "que no están involucrados en la reacción, junto con los objetivos en la jaula, controlando así con precisión el grado de torsión de los enlaces amida. Sin la molécula de relleno, las dos amidas objetivo están confinadas en una jaula. Uno de los dos objetivos está torcido y el otro permanece plano. A diferencia de, cuando el relleno cónico se mezcla y luego se involucra junto con el objetivo en una jaula, el objetivo permanece plano. Cuando una molécula de relleno plana está involucrada con el objetivo, el relleno cambia la forma del objetivo en una estructura retorcida. Los investigadores investigaron las velocidades de reacción de la hidrólisis en los dos casos y encontraron que el relleno plano (objetivo retorcido) acelera la velocidad 14 veces. mientras que el relleno cónico (objetivo plano) aceleró tres veces la velocidad. Las moléculas de relleno permiten a los investigadores ajustar la velocidad de reacción con precisión. Este es un logro sin precedentes que nunca se ha encontrado en estudios anteriores. Esta investigación ofrece un método novedoso para la activación de moléculas inertes y se puede aplicar a una variedad de reacciones orgánicas.
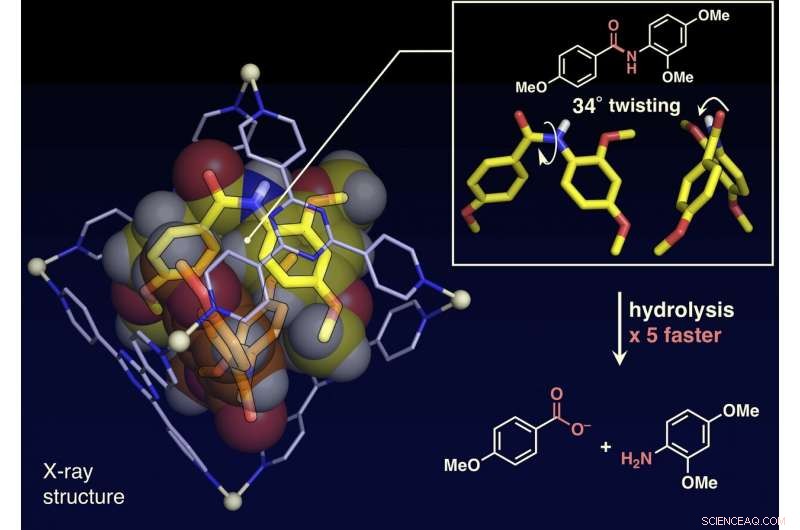
El análisis de la estructura monocristalina mostró que las moléculas de amida planar estaban torcidas hasta 34 grados dentro de la jaula. La velocidad de hidrólisis de una base se aceleró en un factor de cinco. Crédito:NINS / IMS
Los investigadores demostraron que las moléculas de amida se pueden activar girando dentro de la jaula sin engorrosos procesos de modificación química. "Estamos buscando un nuevo tipo de jaula que pueda activar los objetivos con mayor eficiencia y aplicarlos a otras categorías de moléculas objetivo. Con nuestras nuevas jaulas, Desarrollaremos el nuevo método de activación de moléculas inertes. En el futuro, nuestras jaulas se utilizarán como catalizadores, que aprietan y activan selectivamente un enlace específico de una molécula diana y también como agentes de activación para profármacos que actúan en el cuerpo, "dijo Fujita.
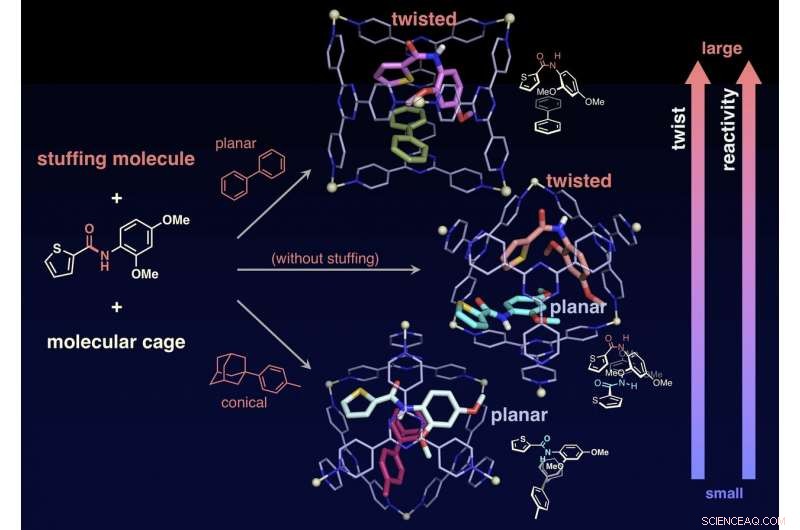
El ángulo de giro y luego la reactividad hacia la hidrólisis, puede controlarse confinando la molécula de relleno junto con la amida diana en la jaula. Crédito:NINS / IMS