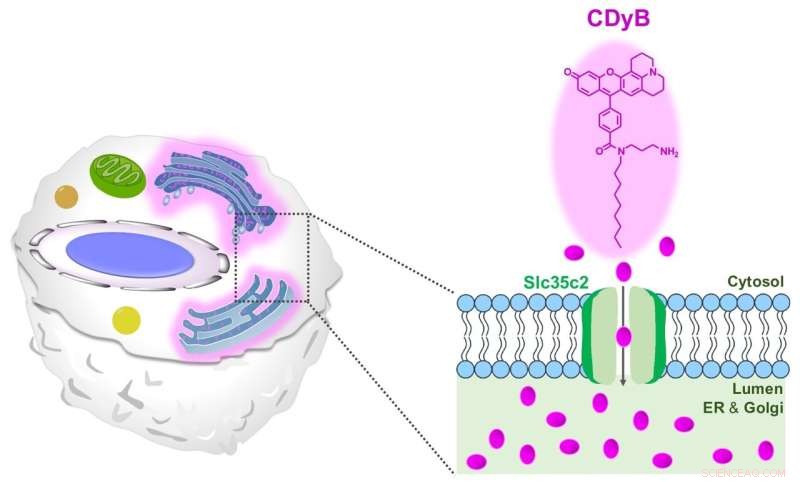
El mecanismo de tinción propuesto de CDyB. Crédito:Instituto de Ciencias Básicas
Nuestro sistema inmunológico es esencial para nuestra supervivencia, ya que nuestros cuerpos están constantemente expuestos a bacterias, virus, parásitos y otros patógenos. Sin un sistema inmunológico, perderíamos rápidamente la guerra contra estos patógenos y sucumbiríamos a estos invasores externos. El sistema inmunológico está compuesto por miles de millones de glóbulos blancos individuales que circulan en nuestro torrente sanguíneo y se mueven en nuestros tejidos, buscando signos de infección o daño tisular. Las defensas del cuerpo consisten en numerosos tipos diferentes de glóbulos blancos que incluyen linfocitos, monocitos y granulocitos. Los linfocitos a su vez se subdividen en células T, células B y células NK.
La identificación de cada tipo de célula es esencial para comprender sus funciones específicas y realizar investigaciones en el campo de la inmunología. Los linfocitos T y B son dos células inmunes adaptativas importantes en los sistemas de defensa de nuestro cuerpo. Sin embargo, el tamaño y la forma similares de las células dificultan su distinción. Actualmente, la distinción de diferentes tipos de células se realiza mediante la tinción de células con anticuerpos fluorescentes que se unen a diferentes grupos de receptores de diferenciación (CD) en la superficie celular.
Ahora, un equipo dirigido por el profesor Chang Young-Tae en el Centro de Autoensamblaje y Complejidad del Instituto de Ciencias Básicas en Pohang, Corea del Sur, desarrolló con éxito una sonda de molécula pequeña CDyB (que significa Compuesto de Designación amarillo para células B ) que puede lograr la distinción de células B vivas de células T. CDyB se descubrió utilizando una biblioteca de fluorescencia imparcial llamada Biblioteca de fluorescencia orientada a la diversidad, o DOFL. Mediante el uso de este proceso, los investigadores pudieron detectar miles de moléculas diferentes por su especificidad para un tipo de célula inmunitaria sobre otra. Cuando se aplicó a una mezcla de células T y B, se encontró que esta nueva sonda tenía una alta selectividad hacia las células B.
CDyB es un nuevo tipo de sonda que no requiere anticuerpos específicos de CD para distinguir diferentes tipos de células. Más bien, se descubrió que era capaz de ingresar a la célula misma y teñir el retículo endoplásmico (ER) y el aparato de Golgi, que son organelos prominentes dentro de las células que son responsables de transportar materiales dentro de las células. Se cree que esto es posible gracias a la capacidad de la molécula para atravesar fácilmente las membranas celulares.
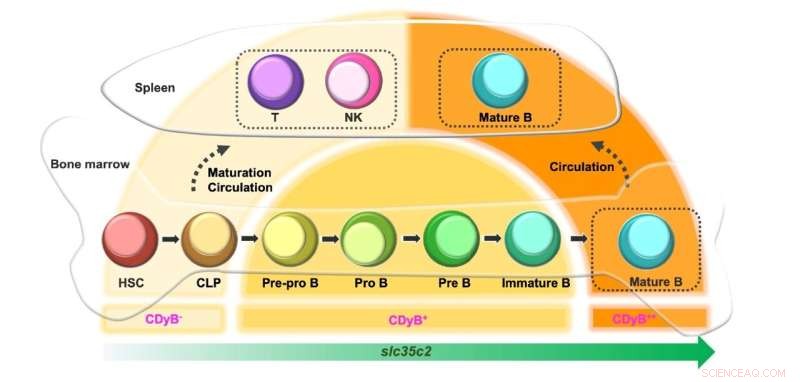
Esquema de la intensidad de fluorescencia de CDyB en función del desarrollo de células B. Crédito:Instituto de Ciencias Básicas
Después de darse cuenta de que CDyB se localiza dentro de los orgánulos ER/Golgi, los investigadores especularon que el mecanismo de la selectividad de las células B se basa en la activación. En otras palabras, algunas moléculas transportadoras deben ser responsables de la captación y acumulación de CDyB dentro de los orgánulos en algunas células, pero no en otras. Por lo tanto, acuñaron el nuevo término, distinción de células vivas orientadas a la puerta (GOLD) para describir este mecanismo recién descubierto de distinguir diferentes tipos de células.
A continuación, los investigadores buscaron averiguar por qué CDyB solo tiñe los orgánulos de las células B, pero no las células T. Los investigadores exploraron más a fondo el mecanismo de la nueva sonda mediante el uso de una biblioteca basada en SLC-CRISPR, que es una plataforma que ofrece una alta probabilidad de elucidación de objetivos de selección sistemática. Mediante el empleo de SLC-CRISPRa y SLC-CRISPRi, los investigadores descubrieron que SLC35C2 era el transportador específico de CDyB, que permite transportar la molécula dentro de los orgánulos. El transportador objetivo se validó aún más mediante el análisis de expresión génica. Los investigadores realizaron más experimentos de inactivación y demostraron que la eliminación del transportador eliminaba la capacidad de la molécula para ser internalizada por el aparato de Golgi/ER de las células diana, lo que demuestra el papel de SlC35C2 en la selectividad de las células B.
Curiosamente, los investigadores observaron que la señal de CDyB era más fuerte en las células B maduras que en las células B inmaduras. Lo más probable es que esto se deba a que la expresión de SLC35C aumenta según la madurez de las células B. Las células progenitoras, como las células madre hematopoyéticas (HSC) y las células progenitoras linfoides comunes (CLP), expresan un nivel bajo de SLC35C2 y, por lo tanto, están mínimamente teñidas por CDyB. Cuando se diferencian en células T y NK, la expresión de SLC35C2 permanece baja, por lo que produce una fluorescencia CDyB débil. Si las células se diferencian en linajes de células B, la expresión de SLC35C2 aumenta durante el proceso de maduración. Los progenitores de células B parcialmente diferenciados (Pre-Pro B, Pro B, Pre B) exhiben una fluorescencia CDyB moderada, y las células B completamente maduras muestran el nivel más alto de fluorescencia CDyB.
En particular, el equipo del profesor Chang desbloqueó previamente otra sonda selectiva de células B llamada CDgB (Compuesto de designación verde para células B) el año pasado. A diferencia de CDyB, distingue las células B de las células T mediante el mecanismo de distinción de células vivas orientadas a lípidos (LOLD). LOLD utiliza la pequeña diferencia en los componentes de la membrana, como la longitud de la cadena de carbono y el contenido de colesterol, y la flexibilidad para la discriminación celular. Mientras que CDyB mostró una fluorescencia más fuerte en las células B maduras, CDgB mostró la tinción más brillante en las células B inmaduras debido a su estructura de membrana más suave. Se espera que la utilización de estas dos moléculas con mecanismos juntos pueda ser una forma efectiva de distinguir diferentes tipos de células en las células sanguíneas.
Este estudio enriquece la caja de herramientas de la sonda molecular y la comprensión molecular para la distinción de células B vivas y abre la posibilidad de un análisis celular multidimensional basado en el mecanismo ortogonal con nuevos conocimientos. Este trabajo fue publicado en la Angewandte Chemie International Edition el 5 de julio. Una nueva sonda fluorescente que puede distinguir las células B de las células T