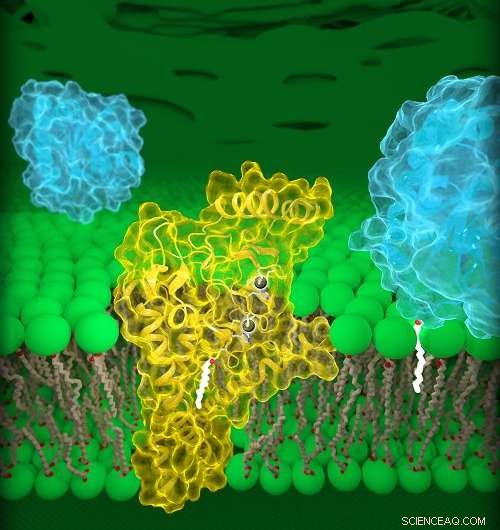
El DHHC20 humano (amarillo) está incrustado en la membrana de Golgi (verde), un compartimento ubicado dentro de las celdas. DHHC20 une una cadena de ácidos grasos (blanca) a una proteína objetivo (azul, primer plano), que ancla la proteína a la membrana de Golgi. Crédito:Jeremy Swan, NICHD / NIH
La primera estructura tridimensional de las proteínas DHHC:enzimas involucradas en muchos procesos celulares, incluido el cáncer:explica cómo funcionan y puede ofrecer un modelo para diseñar medicamentos terapéuticos. Los investigadores han propuesto bloquear la actividad del DHHC para aumentar la eficacia de los tratamientos de primera línea contra las formas comunes de cáncer de pulmón y de mama. Sin embargo, Actualmente no existen medicamentos autorizados que se dirijan a enzimas DHHC específicas. El estudio, dirigido por investigadores del Instituto Nacional de Salud Infantil y Desarrollo Humano Eunice Kennedy Shriver (NICHD), aparece en el último número de Ciencias .
Enzimas DHHC, también llamadas palmitoiltransferasas, modificar otras proteínas uniéndoles una cadena de lípidos, o ácidos grasos, de diferentes longitudes. Esta modificación, llamado palmitoilación, puede cambiar muchas propiedades de una proteína objetivo, como su estructura, función y ubicación dentro de una celda. Los investigadores estiman que casi 1, 000 proteínas humanas se someten a palmitoilación, incluidos los receptores del factor de crecimiento epidérmico (EGFR). Un EGFR conocido es HER2, que está sobreactivado en formas agresivas de cáncer de mama. Los EGFR también pueden sobreactivarse en el cáncer de colon, y cáncer de pulmón de células no pequeñas, el tipo más común de cáncer de pulmón.
El estudio actual detalla las estructuras de una enzima DHHC humana, DHHC20, y la versión de pez cebra de otra enzima DHHC, DHHC15. En tono rimbombante, DHHC20 es la enzima que palmitoila EGFR. Estudios anteriores han demostrado que el bloqueo de DHHC20 hace que las células cancerosas sean más vulnerables a los tratamientos existentes aprobados por la FDA que se dirigen al EGFR. Por lo tanto, comprender la estructura de DHHC20 puede ser importante para el tratamiento de cánceres provocados por EGFR.
"Las mutaciones en las enzimas DHHC están asociadas con varios cánceres y trastornos neurológicos, "según Anirban Banerjee, Doctor., autor principal del estudio y jefe de la Unidad de Biología Química y Estructural de las Proteínas de Membrana del NICHD. "Nuestro estudio ofrece un punto de partida para desarrollar inhibidores de DHHC20 que pueden ayudar en el tratamiento de cánceres comunes y avanzar en el campo de la palmitoilación de proteínas".
El Dr. Banerjee y sus colegas identificaron un componente estructural, una cavidad, de DHHC20 que influye en la longitud de su cadena lipídica. Las mutaciones que alteraron el tamaño relativo de esta cavidad hicieron que DHHC20 usara cadenas de lípidos más cortas o más largas, que presumiblemente cambia los efectos de la palmitoilación en una proteína diana. Los investigadores proponen que la estructura de este sitio explica por qué diferentes enzimas DHHC utilizan ciertas cadenas lipídicas para modificar las funciones de otras proteínas. También ofrece información sobre cómo varias enzimas trabajan juntas en estados de salud y enfermedad.