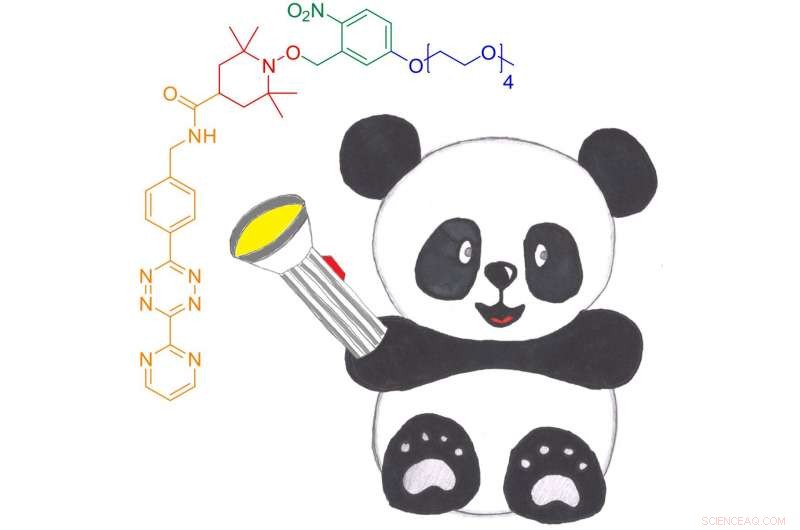
El nuevo nitróxido fotoactivable para la etiqueta de giro de reacción DAinv para proteínas, Panda. Puede ligarse a proteínas a través de una cicloadición DAinv a aminoácidos no canónicos codificados genéticamente. Crédito:Anandi Kugele
El etiquetado de espín dirigido al sitio (SDSL) utilizado en combinación con la espectroscopia de resonancia paramagnética electrónica (EPR) ha sido una técnica probada y confiable para dilucidar la estructura, función y dinámica de proteínas y complejos proteicos. Las etiquetas giratorias a base de nitróxido se encuentran entre las más populares y mejor establecidas porque son pequeñas, no molestan y exhiben excelentes propiedades espectroscópicas. "Los procedimientos ideales de etiquetado por centrifugado exhiben altas velocidades de reacción y selectividad, "explica el profesor Malte Drescher, Profesor de espectroscopia de sistemas complejos en el Departamento de Química de la Universidad de Konstanz y autor principal del estudio junto con el profesor Valentin Wittmann, que se especializa en síntesis orgánica.
"Lograr una alta reactividad y una alta selectividad al mismo tiempo puede ser un problema, "continúa Drescher". Etiquetas giratorias convencionales basadas, por ejemplo, sobre gadolinio (III) o tritilo, mostrar espectros muy amplios y profundidades de modulación bajas o espectros muy estrechos que no son adecuados para el tipo de experimentos que queremos realizar ". Un nuevo estudio publicado por Drescher, Wittmann y su equipo de químicos de la Universidad de Konstanz, que se publicó en línea en la revista Comunicaciones ChemBioChem el 14 de agosto de 2019, introduce un nuevo enfoque para el etiquetado de proteínas que presenta etiquetas de giro basadas en nitróxido y aminoácidos no canónicos codificados genéticamente (ncAA) como objetivos para SDSL.
"Los nitróxidos proporcionan un ancho espectral ideal y acceso a información dinámica, "dice Anandi Kugele, investigador de doctorado en la Escuela de Investigación de Biología Química de Konstanz (KoRS-CB) y primer autor del estudio, quien recibió una prestigiosa beca de viaje del Laboratorio Nacional de Alto Campo Magnético para presentar los resultados en la Conferencia de las Montañas Rocosas de 2019 sobre Resonancia Magnética en Denver, Colorado (Estados Unidos). "Las etiquetas tradicionales a base de nitróxido tienen una estabilidad redox limitada, lo cual es un inconveniente para las aplicaciones dentro de la celda. El desafío para nosotros era aumentar la estabilidad del nitróxido y, por lo tanto, adaptar las etiquetas de giro basadas en nitróxido para el futuro uso rutinario in vivo ". los investigadores desarrollaron una nueva etiqueta de espín que se puede unir a proteínas mediante cicloadición de Diels-Alder (DAinv) de demanda inversa de electrones a ncAA codificados genéticamente, un método que ha demostrado ser adecuado para una amplia gama de aplicaciones in vitro e in vivo. Para lograr la estabilidad del nitróxido, los investigadores utilizaron además una estrategia de protección basada en grupos protectores fotorremovibles, que se sabe que protegen los nitróxidos y los liberan según sea necesario.
La nueva etiqueta de giro, denominada nitróxido fotoactivable para la reacción DAinv, o PaNDA para abreviar:es soluble en agua, EPR activo y eficaz en desprotección tanto in vitro como en pruebas de lisado con las dos proteínas modelo, la proteína verde fluorescente (GFP) y la tiorredoxina oxidorreductasa de Escherichia coli (TRX), que se encuentra en prácticamente todos los organismos conocidos, sugerir. "Necesitamos mejorar el método utilizado para entregar la etiqueta de giro PaNDA a las células y probar las eficiencias de etiquetado y desprotección dentro de la célula". entre otras cosas, ", concluye Malte Drescher:" Pero nuestra investigación demuestra claramente que, en principio, la etiqueta PaNDA se puede utilizar para mediciones de EPR en entornos biológicos desafiantes, incluido el interior de las células. Nuestras pruebas con lisado de E. coli son muy prometedoras a este respecto. Esto abrirá una gama completamente nueva de oportunidades para el estudio de proteínas mediante espectroscopía EPR ".