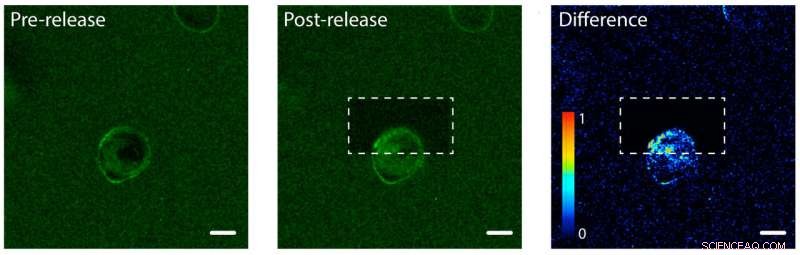
Fotoliberación de proteínas del factor de crecimiento epidérmico (EGF) en un lado de una célula humana. Izquierda:EGF (verde) está atado a un hidrogel de una sola célula humana (centro). La membrana celular se une al EGF, haciendo verde su membrana. Medio:el hidrogel después de usar un láser para desatar y liberar proteínas EGF en la parte superior de la célula. Derecha:una imagen que muestra la diferencia de color verde fluorescente entre las imágenes posteriores al lanzamiento y las anteriores al lanzamiento. Tenga en cuenta el aumento de color en la parte superior de la celda, lo que indica que la célula ha comenzado a internalizar las proteínas EGF no atadas, pero solo en un lado. La barra de escala es de 10 micrómetros. Crédito:Shadish, Benuska y DeForest, 2019, Materiales de la naturaleza
La ingeniería de tejidos podría transformar la medicina. En lugar de esperar a que nuestro cuerpo vuelva a crecer o repare el daño después de una lesión o enfermedad, los científicos podrían volverse complejos, tejidos completamente funcionales en un laboratorio para su trasplante a pacientes.
Las proteínas son clave para este futuro. En nuestros cuerpos las señales de proteínas le dicen a las células a dónde ir, cuándo dividir y qué hacer. En el laboratorio, Los científicos usan proteínas para el mismo propósito:colocar proteínas en puntos específicos sobre o dentro de andamios diseñados, y luego usar estas señales de proteínas para controlar la migración celular, división y diferenciación.
Pero las proteínas en estos entornos también son frágiles. Para que se peguen a los andamios, Los investigadores han modificado tradicionalmente las proteínas utilizando sustancias químicas que eliminan más del 90 por ciento de su función. En un artículo publicado el 20 de mayo en la revista Materiales de la naturaleza , un equipo de investigadores de la Universidad de Washington dio a conocer una nueva estrategia para mantener las proteínas intactas y funcionales modificándolas en un punto específico para que puedan ser atadas químicamente al andamio usando luz. Dado que la correa también se puede cortar con luz láser, este método puede crear patrones en evolución de proteínas señal a través de un andamio de biomaterial para hacer crecer tejidos compuestos por diferentes tipos de células.
"Las proteínas son los principales comunicadores de información biológica, "dijo el autor correspondiente Cole DeForest, un profesor asistente de UW de ingeniería química y bioingeniería, así como investigador afiliado del Instituto de Medicina Regenerativa y Células Madre de la Universidad de Washington. "Impulsan prácticamente todos los cambios en la función celular:diferenciación, movimiento, crecimiento, muerte."
Por esta razón, Los científicos han empleado proteínas durante mucho tiempo para controlar el crecimiento y la diferenciación celular en la ingeniería de tejidos.
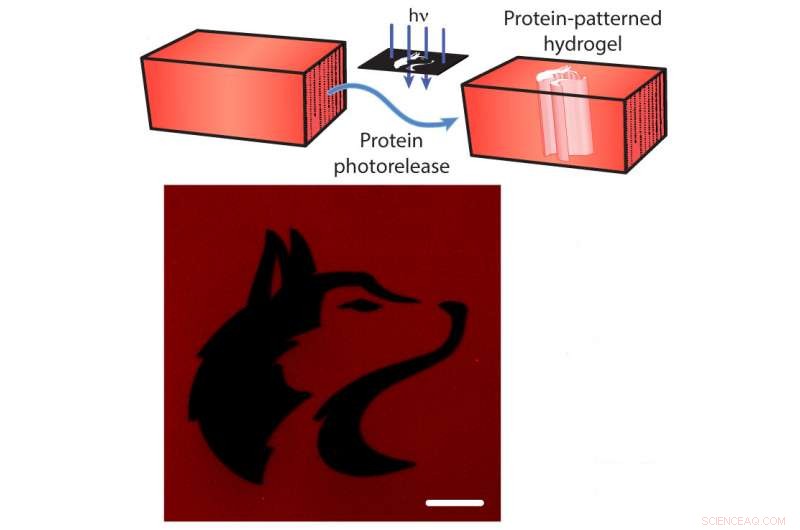
Fotoliberación de proteínas de un hidrogel. Arriba:Las proteínas fluorescentes de rojo cereza m están unidas al hidrogel. Los investigadores pueden cortar la correa con luz dirigida (flechas azules), liberando el mCherry del hidrogel (flechas azules). Abajo:una imagen del hidrogel después de la liberación de mCherry con el patrón de la mascota de la Universidad de Washington (negro). La barra de escala es de 100 micrómetros. Crédito:Shadish, Benuska y DeForest, 2019, Materiales de la naturaleza.
"Pero las químicas más comúnmente utilizadas por la comunidad para unir proteínas a materiales, incluyendo andamios para ingeniería de tejidos, destruir la inmensa mayoría de su función, "dijo DeForest, quien también es miembro de la facultad en el Instituto de Ciencias Moleculares y de Ingeniería de la UW. "Históricamente, Los investigadores han intentado compensar esto simplemente sobrecargando el andamio con proteínas, sabiendo que la mayoría de ellos estarán inactivos. Aquí, hemos ideado una forma generalizable de funcionalizar los biomateriales de forma reversible con proteínas mientras se conserva toda su actividad ".
Su enfoque utiliza una enzima llamada sortasa, que se encuentra en muchas bacterias, para agregar un péptido sintético corto a cada proteína señal en una ubicación específica:el C-terminal, un sitio presente en cada proteína. El equipo diseña ese péptido de manera que unirá la proteína de señal a ubicaciones específicas dentro de un andamio de biomaterial lleno de líquido común en la ingeniería de tejidos. conocido como hidrogel.
Dirigirse a un solo sitio en la proteína de señal es lo que distingue el enfoque del equipo de UW. Otros métodos modifican las proteínas de señal uniendo grupos químicos a ubicaciones aleatorias, que a menudo interrumpe la función de la proteína. Es mucho menos probable que modificar solo el extremo C de la proteína altere su función, según DeForest. El equipo probó el enfoque en más de media docena de tipos diferentes de proteínas. Los resultados muestran que la modificación del extremo C-terminal no tiene un efecto significativo sobre la función de la proteína, y une con éxito las proteínas a través del hidrogel.
Su enfoque es análogo a colgar una obra de arte enmarcada en una pared. En lugar de clavar clavos al azar a través del vidrio, lienzo y marco, colocan un solo cable en la parte posterior de cada marco para colgarlo en la pared.
Además, las correas se pueden cortar mediante la exposición a la luz láser enfocada, provocando la "fotoliberación" de las proteínas. El uso de este sable de luz científico permite a los investigadores cargar un hidrogel con muchos tipos diferentes de señales de proteínas, y luego exponer el hidrogel a la luz láser para desencadenar las proteínas de ciertas secciones del hidrogel. Al exponer selectivamente solo porciones de los materiales a la luz láser, el equipo controló dónde las señales de las proteínas permanecerían atadas al hidrogel.

De izquierda a derecha:Cole DeForest, Gabrielle Benuska, Jared Shadish. Crédito:Dennis Wise / Universidad de Washington
La separación de proteínas es útil en los hidrogeles porque las células podrían captar esas señales, llevándolos al interior de la célula donde pueden afectar procesos como la expresión genética.
El equipo de DeForest probó el proceso de fotoliberación utilizando un hidrogel cargado con factor de crecimiento epidérmico, un tipo de señal de proteína. Introdujeron una línea celular humana en el hidrogel y observaron los factores de crecimiento que se unían a las membranas celulares. El equipo usó un rayo de luz láser para desvincular las señales de proteínas en un lado de una célula individual, pero no del otro lado. En el lado atado de la celda, las proteínas permanecieron en el exterior de la célula ya que todavía estaban adheridas al hidrogel. En el lado libre las señales de las proteínas fueron internalizadas por la célula.
"Según cómo apuntamos a la luz láser, podemos asegurarnos de que diferentes células, o incluso diferentes partes de una sola célula, estén recibiendo diferentes señales ambientales, "dijo DeForest.
Este nivel único de precisión dentro de una sola celda no solo ayuda con la ingeniería de tejidos, pero con investigación básica en biología celular, añadió DeForest. Los investigadores podrían usar esta plataforma para estudiar cómo las células vivas responden a múltiples combinaciones de señales de proteínas, por ejemplo. Esta línea de investigación ayudaría a los científicos a comprender cómo las señales de las proteínas trabajan juntas para controlar la diferenciación celular. curar los tejidos enfermos y promover el desarrollo humano.
"Esta plataforma nos permite controlar con precisión cuándo y dónde se presentan las señales de proteínas bioactivas a las células dentro de los materiales, ", dijo DeForest." Eso abre la puerta a muchas aplicaciones interesantes en la ingeniería de tejidos y la investigación terapéutica ".