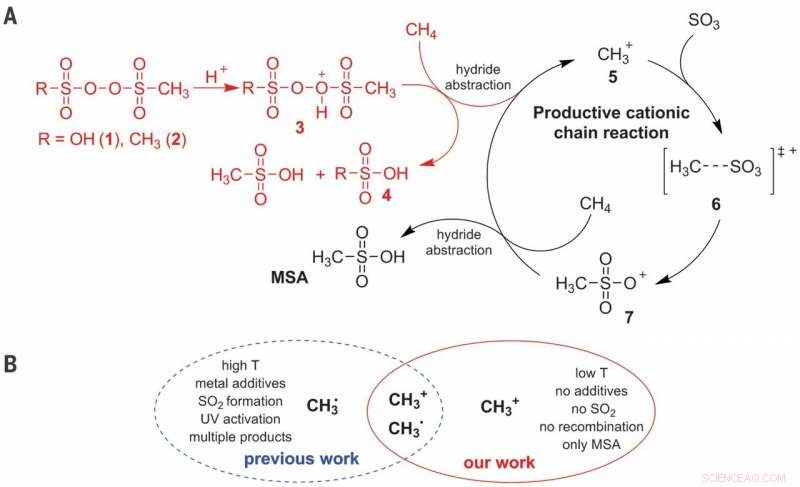
(A) Mecanismo de reacción iónico propuesto para la activación C – H de CH4 en la producción selectiva de MSA (ácido metanosulfónico). (B) Ventajas de la vía catiónica sobre la vía de los radicales. T, temperatura. Crédito:Ciencia, doi:10.1126 / science.aav0177
El metano es un componente principal del gas natural y una de las moléculas más difíciles de controlar de forma controlada. ya que la mayor parte del producto produce dióxido de carbono. La conversión industrial de metano en derivados de alcohol se basa típicamente en una ruta tortuosa que comienza con la sobreoxidación a monóxido de carbono. Aunque los enfoques más directos se han mostrado prometedores en medios muy ácidos a pequeña escala, no son muy rentables. En un estudio reciente ahora publicado en Ciencias , Christian Díaz-Urrutia y Timo Ott, del departamento de I + D de la empresa Grillo-Werke AG, describen una reacción a escala de planta piloto que combinó directamente metano (CH 4 ) y trióxido de azufre (SO 3 ) en ácido sulfúrico (H 2 ASI QUE 4 ) para formar metanosulfónico (CH 4 O 3 S) ácido sin subproductos. La reacción pareció proceder a través de un mecanismo de cadena catiónica iniciado mediante la adición de una baja concentración de peróxido de sulfonilo, propagado por metenio (CH 3 + ) moléculas.
La funcionalización directa del metano para formar productos de valor agregado es un desafío debido a la posible sobreoxidación en muchos entornos de reacción y la sulfonación es un enfoque atractivo para lograr la selectividad de interés. En el proceso práctico, Díaz-Urrutia y Ott produjeron ácido metanosulfónico (MSA) utilizando solo dos reactivos principales; metano y trióxido de azufre. Lograron una selectividad del 99 por ciento y un rendimiento de MSA en el trabajo. Los científicos basaron el iniciador electrofílico en un derivado de peróxido de sulfonilo, que protonaron en condiciones superacídicas para producir un átomo de oxígeno altamente electrófilo capaz de activar un enlace C-H del metano. Propusieron estudios mecanicistas para apoyar la formación de un catión metenio (CH 3 + ) como un intermedio clave durante la reacción. El método propuesto es escalable con reactores conectados en serie para producir prospectivamente hasta 20 toneladas métricas de MSA por año.
Si bien las técnicas de fracturación hidráulica a gran escala y la producción de biogás han proporcionado acceso a grandes cantidades de metano inactivo, la transformación química más grande del metano permanece confinada a los procesos Fischer-Tropsch de alta demanda energética. En el presente, el metano se convierte industrialmente en gas de síntesis, una mezcla de monóxido de carbono e hidrógeno, para formar productos útiles, incluidos el metanol y los hidrocarburos de Fischer-Tropsch, que se sintetizan en pasos posteriores. La producción de gas de síntesis limita considerablemente los costos, sin embargo; Las plantas de "megametanol" o el complejo de perlas Fischer-Tropsch en Qatar superan los 10 millones de toneladas métricas (TM) de la producción anual total de hidrocarburos. Como resultado, la conversión directa de metano en productos valiosos mediante una técnica económicamente viable son de gran interés.
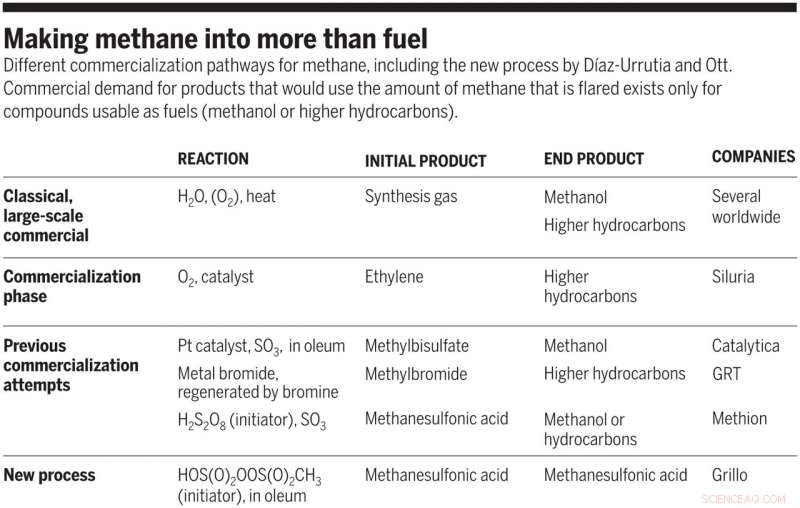
Convertir metano en algo más que combustible. Diferentes vías de comercialización del metano, incluido el nuevo proceso de Díaz-Urrutia y Ott. La demanda comercial de productos que utilizarían la cantidad de metano que se quema existe solo para compuestos utilizables como combustibles (metanol o hidrocarburos superiores). Crédito:Ciencia, doi:10.1126 / science.aav0177
En este contexto, el potencial para sulfonar metano (CH 4 ) al ácido metanosulfónico (CH 4 O 3 S, MSA) ha logrado atención sustancial debido a la abundancia de materias primas y la capacidad para su rápida integración en los procesos químicos industriales existentes. MSA es biodegradable y no oxidante con aplicaciones potenciales en el reciclaje de metales, almacenamiento de energía y producción de biodiesel. Los trabajos anteriores sobre metanosulfonación adolecían de bajos rendimientos y conversiones, debido a la recombinación de radicales libres, dando lugar a productos secundarios no deseados como el etano, haciendo que los métodos sean inadecuados para la producción a gran escala. Técnicamente, el equilibrio entre reactividad y selectividad requerido por un proceso industrial puede ser proporcionado por la química de superácidos. Díaz-Urrutia y Ott informaron sobre el tratamiento de oleum (20 a 60 por ciento de trióxido de azufre) con CH 4 aproximadamente a los 50 0 C usando menos de 1 porcentaje molar del iniciador electrófilo para formar MSA con un rendimiento del 99 por ciento y una selectividad del 99 por ciento.
CH 4 (g) + SO 3 (l) → CH 3 ASI QUE 3 H (l)
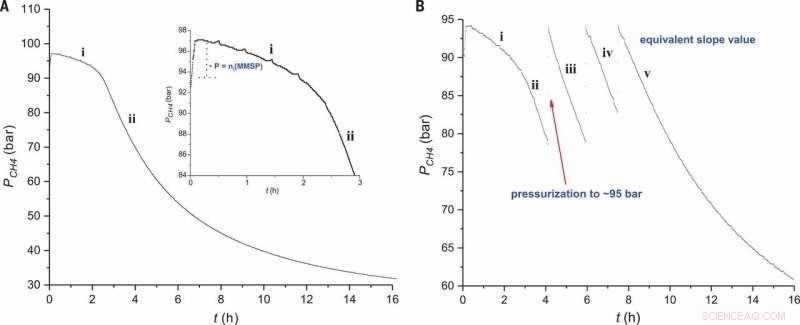
Perfil de reacción para la sulfonación de metano. La presión de CH4 se representa en función del tiempo en condiciones estándar (A) utilizando un iniciador electrofílico al 0,9% en moles (Figura 2, entrada 2) y (B) adiciones sucesivas de CH4 (Fig.2, entrada 3). El recuadro en (A) muestra una vista ampliada de la región i. Crédito:Ciencia, doi:10.1126 / science.aav0177.
Los científicos primero estudiaron la reacción en un sistema por lotes para optimizar las condiciones experimentales y obtener más información sobre el mecanismo de reacción. Para el iniciador electrofílico, utilizaron ácido sulfúrico monometilsulfonilperóxido (MMSP) para mejorar la viabilidad técnica. Para aumentar la productividad, utilizaron un reactor de cuatro litros en lugar de un reactor de 400 mL, debido a mayores cantidades de CH 4 formándose en el espacio de cabeza del reactor más grande. De este modo, los científicos pudieron mantener cantidades constantes de metano durante toda la reacción para obtener mayores rendimientos de MSA. Utilizaron una temperatura óptima de 50 0 C para lograr más del 99 por ciento de selectividad hacia MSA, mientras que las vías de radicales anteriores tuvieron resultados similares a temperaturas más altas (85 0 C) debido a la descomposición térmica del iniciador electrófilo de peróxido de sulfonilo. Los experimentos a baja temperatura también podrían ofrecer una alta conversión y selectividad de MSA, pero requirió tiempos de reacción más largos. Díaz-Urrutia y Ott proporcionaron información comparativamente para apoyar un mecanismo no radical en el presente trabajo.
Cuando los científicos examinaron el perfil de reacción del experimento, observaron un período de inducción inmediatamente después de la adición del reactor electrofílico, donde la cantidad de MSA (producto) era proporcional a la cantidad inicial de MMSP (iniciador). En la etapa dos del perfil de reacción, observaron la solubilidad del CH 4 Disminuir al aumentar la presión en el reactor. Se determinó que la energía de activación del proceso era 111 ± 1 kJ / mol, similares a los reportados anteriormente. La vía catiónica descrita se produjo en condiciones muy específicas. Los investigadores lograron una alta selectividad a través de cambios electrónicos en sustituciones electrofílicas, a diferencia de las reacciones de abstracción de átomos basadas en radicales libres informadas anteriormente.

Sulfonación de metano a MSA. (A) Esquema del proceso Díaz-Urrutia y Ott. La reacción procede como una cascada a través de reactores conectados en serie. La planta piloto podría producir hasta 20 toneladas métricas de MSA por año. El exceso de SO3 se apaga en el reactor Q, el exceso de corriente de CH4 y la corriente del sumidero de MSA / H2SO4 se reciclan de nuevo al reactor 1, y la mezcla enriquecida con MSA se destila en la columna D para obtener MSA puro. (B) La concentración de MSA aumenta a medida que pasa por los reactores. (C) Reactor de ventana de cuarzo alargado con impulsor de gas, para mejorar la mezcla de CH4. Crédito:Ciencia, doi:10.1126 / science.aav0177.
Dado que los resultados iniciales fueron muy prometedores, los científicos construyeron una planta piloto y probaron la viabilidad económica y técnica de la producción de MSA a escala industrial. Díaz-Urrutia y Ott construyeron la planta con una capacidad proyectada de 20 toneladas métricas / año de producción de MSA, basado en sus reacciones por lotes a escala de laboratorio, y tuvo en cuenta la solubilidad y el reciclaje del metano, así como para la concentración de trióxido de azufre y metano. Esta configuración permitió a los científicos aumentar constantemente la concentración de MSA a medida que la mezcla de reacción pasaba por los reactores. Cuando utilizaron cromatografía de gases con detección de ionización de llama (GC-FID) para monitorear las muestras, no detectaron la presencia de alcanos superiores en la corriente reciclada de metano o cualquier otro producto de recombinación de radicales, permitiendo su uso directo como stock de retroalimentación para la reacción en cascada.
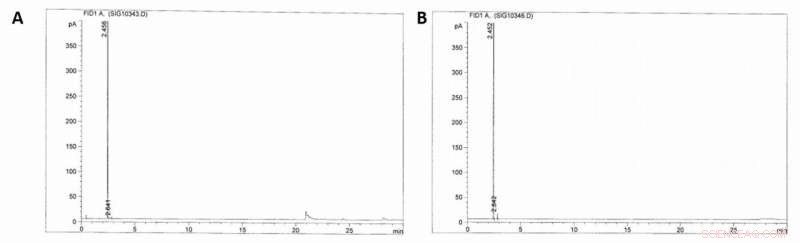
Cromatogramas GC-FID. A) Cromatograma GC-FID de la fase gaseosa del reactor (100 bar) antes de que se produzca la sulfonación del metano. B) Cromatograma GC-FID de la fase gaseosa después (~ 40 bar) de que se haya producido la sulfonación del metano (16 h, Ácido sulfúrico humeante 36%, 500C). Crédito:Ciencia, doi:10.1126 / science.aav0177.
Para permitirse MSA puro, Díaz-Urrutia y Ott completaron el proceso con un paso final de destilación. Luego reciclaron la mezcla restante de ácido sulfúrico y MSA al primer reactor para la regeneración continua de trióxido de azufre y ácido sulfúrico (SO 3 y H 2 ASI QUE 4 ). Usando las cuatro cámaras de reacción de la configuración, los científicos pudieron producir 200 kg de MSA puro por semana, que asciende a dos o tres toneladas métricas en 80 días. De este modo, la combinación demostrada de alta selectividad, la conversión y la economía del átomo hicieron que el proceso fuera ideal para la valorización a gran escala de los reactivos de metano y trióxido de azufre fácilmente disponibles.
Si este nuevo proceso de ácido metanosulfónico tiene éxito en el mercado, Los reactivos más baratos podrán reemplazar los ácidos minerales actualmente en uso. Sin embargo, incluso si la producción de MSA aumentara drásticamente, la cantidad de metano consumida en el proceso aún sería eclipsada por las cantidades quemadas. Sin embargo, el trabajo de Díaz-Urrutia y Ott predice un nuevo proceso químico sintético para sintetizar una sustancia química interesante, permitiendo a los científicos visualizar una gama de productos de valor agregado que se derivarán del metano o alcanos superiores utilizando esta ruta de la química superácida en el futuro.
© 2019 Science X Network