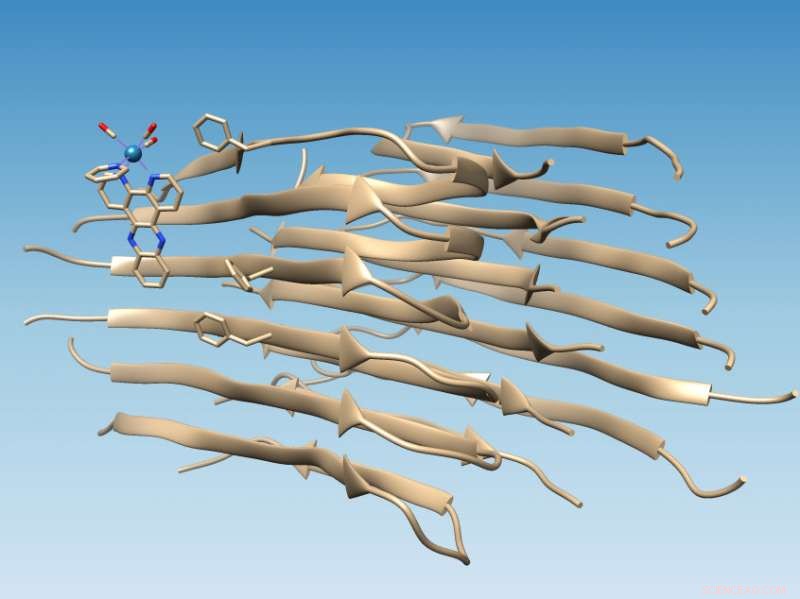
Un complejo a base de renio desarrollado en la Universidad de Rice se une a las fibrillas del péptido beta amiloide mal plegado, que marca la ubicación de una hendidura hidrofóbica que podría servir como objetivo de un fármaco, y oxida la fibrilla, que cambia su química de una manera que podría prevenir una mayor agregación. Crédito:Grupo Martí / Universidad Rice
Una sonda inventada en la Universidad de Rice que se enciende cuando se une a un péptido beta amiloide mal plegado, del tipo que se sospecha que causa la enfermedad de Alzheimer, ha identificado un sitio de unión específico en la proteína que podría facilitar mejores medicamentos para tratar la enfermedad.
Aun mejor, el laboratorio ha descubierto que cuando se ilumina la sonda metálica, cataliza la oxidación de la proteína de una manera que creen que podría evitar que se agregue en el cerebro de los pacientes.
El estudio realizado en fibrillas amiloides largas respalda las simulaciones por computadora de colegas de la Universidad de Miami que predijeron que el complejo de metal fotoluminiscente se adheriría al péptido amiloide cerca de una hendidura hidrófoba (que evita el agua) que aparece en la superficie del agregado de fibrillas. Esa hendidura presenta un nuevo objetivo para las drogas.
Encontrar el sitio fue relativamente simple una vez que el laboratorio del químico de Rice, Angel Martí, usó sus complejos a base de renio para apuntar a las fibrillas. El complejo de conmutación de luz se ilumina cuando se lo golpea con luz ultravioleta, pero cuando se une a la fibrilla se vuelve más de 100 veces más brillante y provoca la oxidación del péptido amiloide.
"Es como caminar por la playa, "Dijo Martí." Puedes ver que alguien estaba allí antes que tú mirando las huellas en la arena. Si bien no podemos ver el complejo de renio, podemos encontrar la oxidación (huella) que produce en el péptido amiloide.
"Esa oxidación solo ocurre justo al lado del lugar donde se une, "La verdadera importancia de esta investigación es que nos permite ver con un alto grado de certeza dónde las moléculas pueden interactuar con las fibrillas beta amiloides".
El estudio aparece en la revista Chem .
"Creemos que esta hendidura hidrofóbica es un sitio de unión general (en beta amiloide) para moléculas, "Dijo Martí." Esto es importante porque la agregación beta amiloide se ha asociado con la aparición de la enfermedad de Alzheimer. Sabemos que la beta amiloide insoluble fibrilar es tóxica para los cultivos celulares. Los oligómeros amiloides solubles que están hechos de varias unidades de beta amiloide mal plegadas también son tóxicos para las células. probablemente incluso más que fibrilar.
"Existe interés en encontrar medicamentos que apaguen los efectos nocivos de los agregados beta amiloides, ", dijo." Pero para crear medicamentos para estos, primero necesitamos saber cómo los fármacos o moléculas en general pueden unirse e interactuar con estas fibrillas, y esto no era muy conocido. Ahora tenemos una mejor idea de lo que necesita la molécula para interactuar con estas fibrillas ".

Una sonda metálica se enciende cuando se une a un péptido beta amiloide mal plegado en un experimento en la Universidad de Rice. La sonda identificó un sitio de unión que podría facilitar mejores medicamentos para tratar la enfermedad de Alzheimer. Crédito:Brandon Martin / Rice University
Cuando los péptidos amiloides se pliegan correctamente, ocultan sus residuos hidrófobos mientras exponen sus residuos hidrófilos (que atraen el agua) al agua. Eso hace que las proteínas sean solubles, Dijo Martí. Pero cuando la beta amiloide se pliega mal, deja dos residuos hidrofóbicos, conocida como Valina 18 y Fenilalanina 20, expuesto para crear la hendidura hidrofóbica.
"Es perfecto, porque entonces las moléculas con dominios hidrófobos se unen allí, "Dijo Martí." Son compatibles con esta hendidura hidrofóbica y se asocian con la fibrilla, formando una fuerte interacción ".
Si la oxidación resultante evita que las fibrillas se agreguen más en la sustancia pegajosa que se encuentra en el cerebro de los pacientes con Alzheimer, puede ser el comienzo de una estrategia útil para detener la agregación antes de que aparezcan los síntomas de la enfermedad.
"Es un sistema muy atractivo porque utiliza luz, que es un recurso barato, "Dijo Martí." Si podemos modificar los complejos para que absorban la luz roja, que es transparente al tejido, podríamos realizar estas modificaciones fotoquímicas en animales vivos, y tal vez algún día en humanos ".

Desde la izquierda, Christopher Pennington, científico investigador de la Universidad Rice, el estudiante de posgrado Bo Jiang y Angel Martí, profesor asociado de química y bioingeniería, ejecutar un experimento de beta amiloide en el laboratorio Martí. Crédito:Brandon Martin / Rice University
Dijo que la activación de la luz permite a los investigadores tener un "control exquisito" de la oxidación.
"Imaginamos que algún día podría ser posible prevenir los síntomas de la enfermedad de Alzheimer al apuntar a la beta amiloide de la misma manera que tratamos el colesterol en las personas ahora para prevenir las enfermedades cardiovasculares". "Dijo Martí." Eso sería maravilloso ".