La interferencia de ARN (ARNi) es un proceso biológico fascinante en gusanos, plantas, hongos y metazoos que ha sido una herramienta valiosa para estudiar la función genética y como terapia.
En Caenorhabditis elegans, la proteína transmembrana de múltiples pasos, la proteína defectuosa de interferencia de ARN sistémica 1 (SID-1), desempeña un papel indispensable en la captación y entrega de ARN bicatenario (ARNds) entre células y tejidos, lo que conduce a la formación de ARNi sistémico. P>
Además, dos homólogos de SID-1 humanos, el miembro 1 de la familia transmembrana SID1 (SIDT1) y SIDT2, han sido implicados en el transporte de ARN. Sin embargo, aún se desconocen los mecanismos moleculares subyacentes de cómo SID-1 distingue específicamente el ARNds del ARN monocatenario (ARNss) y el ADN y facilita el transporte posterior de ARNds entre células.
Las respuestas a estas preguntas son importantes para comprender la ARNi sistémica y ayudar en las aplicaciones relacionadas con el ARN.
El Dr. Zhang Jiangtao, del grupo del Prof. Jiang Daohua del Instituto de Física de la Academia de Ciencias de China, ha demostrado cómo SID-1 reconoce específicamente el dsRNA y ha proporcionado información importante sobre la internalización del dsRNA por parte de SID-1 mediante la combinación de crio-EM, experimentos in vitro e in vivo. El trabajo se publica en la revista Nature Structural &Molecular Biology. .
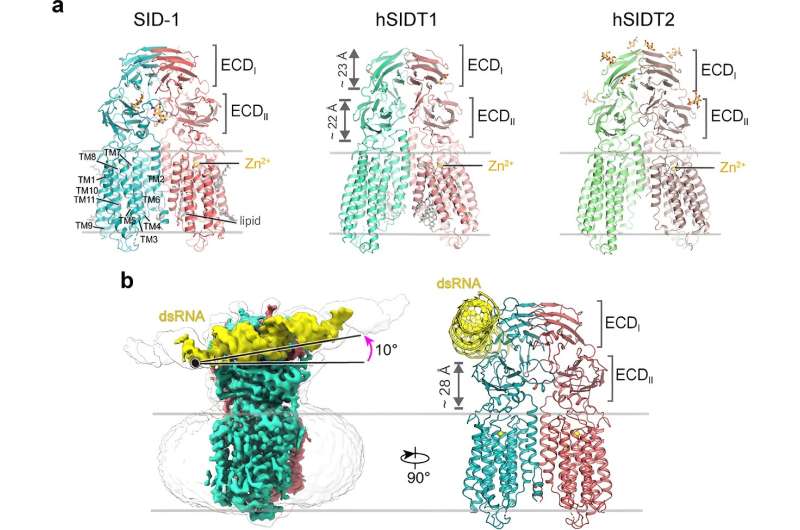
Durante más de dos décadas, se pensó que SID-1 funcionaba como un canal de ARNbc. Aquí, los investigadores resolvieron estructuras crio-EM de alta resolución de SID-1 y los homólogos de SID-1 humanos SIDT1 y SIDT2, revelando la arquitectura conservada de C. elegans y los homólogos de SID-1 humanos.
Los homólogos de SID-1 están organizados de forma homodimérica. Sorprendentemente, el dímero SID-1 no muestra un poro obvio dentro del dominio transmembrana, lo que sugiere que SID-1 puede no funcionar como un canal de ARNbc. Los ensayos de unión de MST confirmaron que SID-1 puede unirse potente y específicamente al dsRNA pero no al dsDNA.
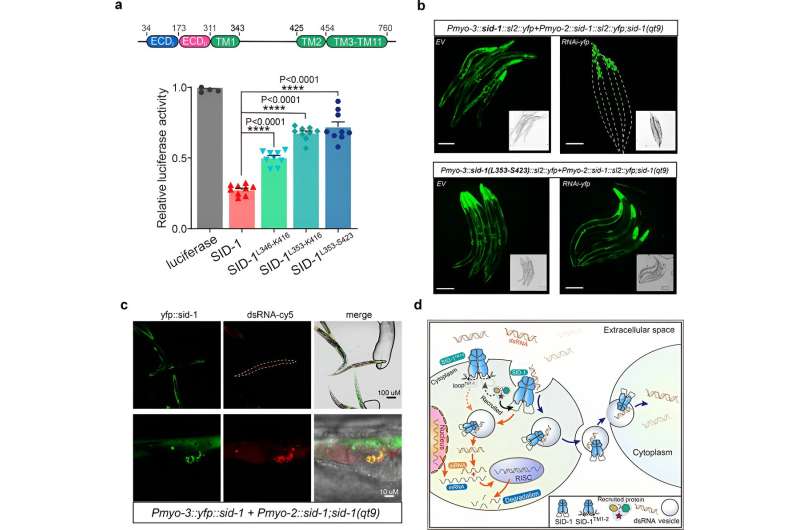
Posteriormente, los investigadores obtuvieron la estructura crio-EM del complejo SID-1-ARNds, demostrando el modo de unión detallado del ARNds y los determinantes moleculares de cómo SID-1 distingue el ARNds del ARNss y el ADN.
Curiosamente, tales determinantes no están presentes en SIDT1 o SIDT2 humanos. Los hallazgos estructurales fueron respaldados por estudios de mutagénesis que utilizaron ensayos de unión de MST, captación de ARNbc en células S2 y ensayos de ARNi sistémico in vivo.
Finalmente, los investigadores muestran que la eliminación de las largas hélices transmembrana 1 y 2 del bucle intracelular no afectó la dimerización de SID-1, la localización celular o la unión del ARNds, pero afectó significativamente la absorción de ARNds en las células S2 y el ARNi sistémico en C. elegans.
Además, la colocalización reveló que SID-1 y dsRNA se ubican conjuntamente en orgánulos subcelulares similares a vesículas. Con base en estos resultados, los investigadores proponen que SID-1 funciona como un receptor de dsRNA y facilita la internalización posterior de dsRNA mediante el reclutamiento de proteínas relacionadas con los endocitos a través del bucle largo.
Más información: Jiangtao Zhang et al, Conocimientos estructurales sobre el reconocimiento y transporte de ARN bicatenario mediante SID-1, Biología estructural y molecular de la naturaleza (2024). DOI:10.1038/s41594-024-01276-9
Información de la revista: Naturaleza Biología estructural y molecular
Proporcionado por la Academia China de Ciencias