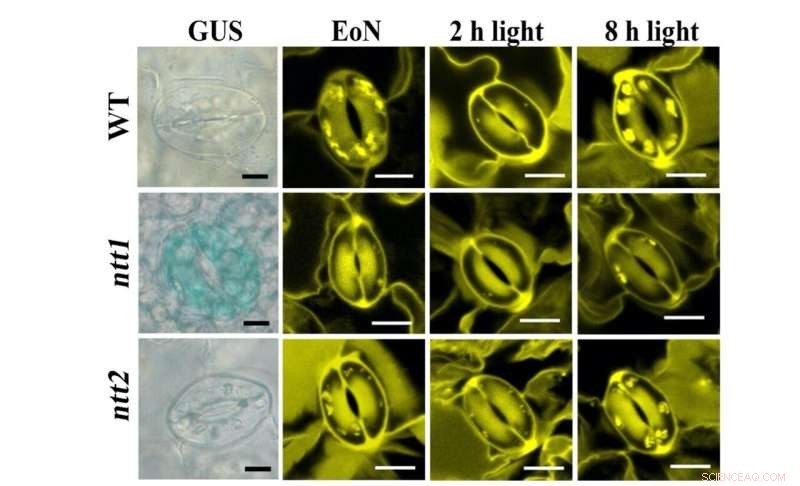
Figura 1:Tinción de transportadores NTT (azul, panel izquierdo) y gránulos de almidón (amarillo, panel derecho) en GC. Crédito:Universidad de Hong Kong
Durante décadas se ha debatido si las células protectoras (GC) llevan a cabo la fotosíntesis. Estudios anteriores sugirieron que los cloroplastos de las células protectoras (CCG) no pueden reparar el CO2 pero estudios posteriores argumentaron lo contrario. Hasta hace poco, ha sido controvertido si los GCC y/o la fotosíntesis de los GC juegan un papel directo en los movimientos estomáticos. El Dr. Boon Leong LIM, Profesor Asociado de la Facultad de Ciencias Biológicas de la Universidad de Hong Kong (HKU), en colaboración con la Dra. Diana SANTELIA de ETH Zürich, descubrió la fuente genuina de combustible de los GC y desenredó el misterio. Los hallazgos fueron publicados recientemente en la prestigiosa revista Nature Communications .
Por la mañana, la luz del sol hace que se abran los estomas, que son pequeños poros en las hojas de las plantas. Esto dejó CO2 en y O2 para impulsar la fotosíntesis. La apertura de los estomas consume una gran cantidad de trifosfato de adenosina (ATP), la moneda de energía celular, pero las fuentes de ATP para la apertura de los estomas permanecieron oscuras. Algunos estudios sugirieron que los GCC realizan la fotosíntesis y exportan ATP al citosol para energizar la apertura de los estomas. En los cloroplastos del mesófilo, se generan ATP y NADPH (nicotinamida-adenina dinucleótido fosfato) a partir de fotosistemas, que se utilizan como combustible para la fijación de CO2 .
Al emplear sensores de proteínas de fluorescencia en la planta, el equipo del Dr. Boon Leong Lim en HKU pudo visualizar la producción en tiempo real de ATP y NADPH en los cloroplastos de células mesófilas (MCC) de una planta modelo, Arabidopsis thaliana. "Sin embargo, no pudimos detectar ninguna producción de ATP o NADPH en los GCC durante la iluminación. Desconcertados por esta observación inesperada, contactamos a una experta en el metabolismo de las células protectoras, la Dra. Diana Santelia de ETH Zürich, para colaborar", dijo el Dr. Lim. Durante la última década, el laboratorio de Santelia proporcionó conocimientos profundos e importantes sobre el metabolismo del azúcar y el almidón en las células protectoras (GC) que rodean los poros estomáticos en la superficie de la hoja.
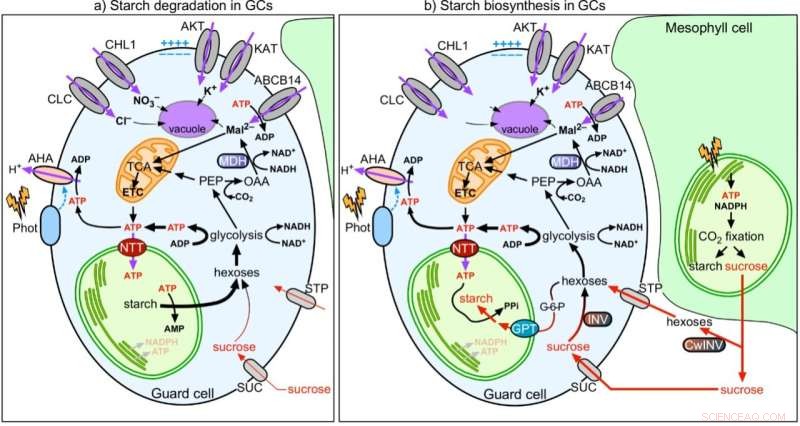
Figura 2:Modelo de la coordinación de la función estomática con el metabolismo del almidón y malato en células de guarda. Crédito:Universidad de Hong Kong
En esfuerzos conjuntos, el equipo muestra que, a diferencia de las células del mesófilo (MC), la fotosíntesis de GC es poco activa. Los azúcares sintetizados y suministrados por los MC se importan a los GC y las mitocondrias los consumen para generar ATP para la apertura de los estomas. A diferencia de los MCC, los GCC toman ATP citosólico a través de los transportadores de nucleótidos (NTT) en la membrana del cloroplasto para activar la síntesis de almidón durante el día. Al amanecer, mientras los MC comienzan a sintetizar almidón y exportan sacarosa, los GC degradan el almidón en azúcares para suministrar energía y aumentar la presión de turgencia para la apertura de los estomas. Por lo tanto, la función de los GCC para servir como almacén de almidón es importante para la apertura de los estomas. Mientras que los MC corrigen el CO2 en los cloroplastos a través del ciclo de Calvin-Benson-Bassham (CBB), CO2 la fijación en el citosol es la vía principal del CO2 la asimilación en GC, donde el malato del producto aguas abajo, también es un soluto importante para aumentar la presión de turgencia para la apertura de los estomas. En conclusión, los GC se comportan más como un tejido sumidero (receptor de azúcares) que fuente (proveedor de azúcares). Su función está estrechamente relacionada con la de los MC para coordinar de manera eficiente el CO2 captación a través de estomas y CO2 fijación en MCs.
"Estaba muy emocionada cuando el Dr. Lim se puso en contacto conmigo para pedirme que colaborara en este proyecto", dijo la Dra. Diana Santelia. "Hemos estado tratando de aclarar estas preguntas fundamentales utilizando enfoques de genética molecular. La combinación de nuestra experiencia respectiva ha sido una estrategia ganadora", continuó. La Dra. Sheyli LIM, primera autora del artículo y ex doctora. El estudiante del grupo de Lim comentó:"Los sensores de proteína de fluorescencia in planta que desarrollamos son herramientas poderosas para visualizar cambios dinámicos de las concentraciones de moléculas de energía en células y orgánulos de plantas individuales, lo que nos permite resolver algunas preguntas clave en la bioenergética de las plantas. Estoy feliz de publicar nuestros descubrimientos en Nature Communications utilizando esta nueva tecnología".