Investigadores australianos han arrojado luz sobre las capacidades de cambio de forma de los conjuntos de proteínas, con resultados que podrían revolucionar campos que van desde la biofabricación hasta el desarrollo de vacunas.
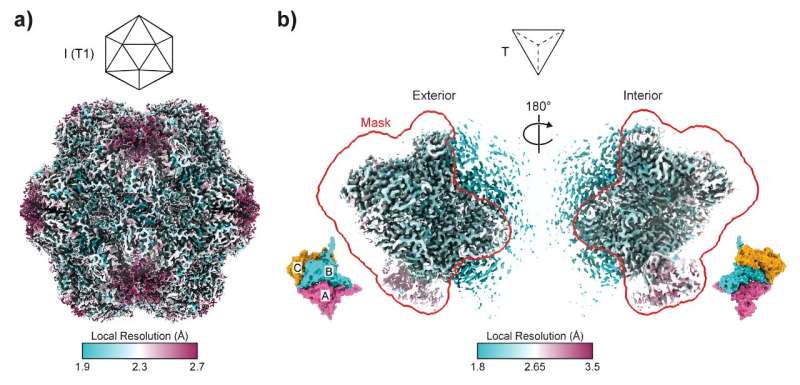
Dirigida por el Dr. Taylor Szyszka de la Universidad de Sydney y el Dr. Yu Heng Lau, del Centro de Excelencia ARC en Biología Sintética, la investigación se publicó hoy en las Proceedings of the National Academy of Sciences. Se adentra en el intrincado mundo de las encapsulinas. Estas jaulas de proteínas icosaédricas desempeñan un papel crucial en la fabricación de nanorreactores, y sus poros actúan como puertas a pequeñas nanofábricas.
"Al manipular los poros y cambiar su tamaño y carga, podemos tener un mejor control sobre los sustratos que ingresan a las jaulas y que las enzimas empaquetadas en su interior los convierten en productos", dice el Dr. Szyzska.
Sin embargo, la exploración del equipo dio un giro inesperado cuando comenzaron a realizar ligeras mutaciones para observar los efectos.
Esta tirada de dados moleculares condujo a la creación de estructuras que se asemejan a tetraedros, una forma de pirámide muy diferente de las habituales encapsulinas esféricas. En términos de forma de ensamblaje, es similar a cambiar un dado de 20 caras por uno de cuatro caras. Estos conjuntos tetraédricos, que comprenden apenas 36 subunidades de proteínas en comparación con las 180 habituales, abren un mundo de posibilidades nunca antes exploradas en la ingeniería de proteínas
"Lo que descubrimos es que se requieren mutaciones mínimas para cambiar drásticamente la forma del ensamblaje final", dice el Dr. Szyszka. "Esperábamos que fuera un proceso mucho más complicado."
Los hallazgos del estudio no sólo desafían los conocimientos existentes sobre el ensamblaje de proteínas, sino que también ofrecen conocimientos sobre la biología evolutiva. Las encapsulinas, aunque no son virus en sí, comparten vínculos evolutivos con las estructuras virales. Los investigadores especulan que la flexibilidad observada en las encapsulinas podría atribuirse a su menor tamaño de carga en comparación con los virus, lo que podría influir en su capacidad para adoptar diversas formas.
"Este descubrimiento sugiere que hay otras formas que podemos crear, con amplias implicaciones para la bioingeniería y la biofabricación", afirma el Dr. Szyszka.
Con más investigaciones, el equipo espera desbloquear todo el potencial de estas proteínas que cambian de forma, allanando el camino para innovaciones que podrían remodelar las industrias y mejorar la salud humana.
Más información: Taylor N. Szyszka et al, La mutación puntual en una cápside similar a un virus impulsa la reducción de la simetría para formar jaulas tetraédricas, Actas de la Academia Nacional de Ciencias (2024). DOI:10.1073/pnas.2321260121
Información de la revista: Actas de la Academia Nacional de Ciencias
Proporcionado por el Centro de Excelencia ARC en Biología Sintética (CoESB)