Consideremos el erizo de mar. En concreto, el erizo pintado:Lytechinus pictus, una pelota de ping-pong espinosa del Océano Pacífico oriental.
La especie es prima más pequeña y de espinas más cortas de los erizos morados que devoran los bosques de algas. Producen cantidades masivas de espermatozoides y óvulos que se fertilizan fuera de sus cuerpos, lo que permite a los científicos observar el proceso de creación de erizos de cerca y a escala. Una generación da origen a la siguiente en cuatro a seis meses. Comparten más material genético con los humanos que las moscas de la fruta y no pueden volar; en resumen, un animal de laboratorio ideal para el biólogo del desarrollo.
Los científicos llevan aproximadamente 150 años utilizando erizos de mar para estudiar el desarrollo celular. A pesar del estatus de los erizos como superreproductores, las preocupaciones prácticas a menudo obligan a los científicos a centrar su trabajo en animales más fácilmente accesibles:ratones, moscas de la fruta, gusanos.
Los científicos que trabajan con ratones, por ejemplo, pueden pedir animales en línea con las propiedades genéticas específicas que esperan estudiar:animales transgénicos, cuyos genes han sido modificados artificialmente para expresar o reprimir ciertos rasgos.
Los investigadores que trabajan con erizos normalmente tienen que pasar parte del año recogiéndolos del océano.
"¿Te imaginas si los investigadores de ratones estuvieran colocando una trampa para ratones todas las noches y lo que atraparan fuera lo que estudiaran?" dijo Amro Hamdoun, profesor del Instituto Scripps de Oceanografía de UC San Diego.
Los invertebrados marinos representan alrededor del 40% de la diversidad biológica del mundo animal, pero aparecen en una escasa fracción de un porcentaje de los estudios basados en animales. ¿Qué pasaría si los investigadores pudieran acceder a los erizos de mar tan fácilmente como los ratones? ¿Y si fuera posible crear y criar líneas de erizos transgénicos?
"¿Sabes que durante la pandemia todo el mundo hacía masa madre? No soy bueno haciendo masa madre", dijo Hamdoun recientemente en su oficina en Hubbs Hall de Scripps. En cambio, puso su mirada en un proyecto de otro tipo:un nuevo animal de laboratorio transgénico, "una mosca de la fruta del mar".
En marzo, el laboratorio de Hamdoun publicó un artículo sobre el bioRxiv. Servidor de preimpresión que demuestra la inserción exitosa de un fragmento de ADN extraño (específicamente, una proteína fluorescente de una medusa) en el genoma de un erizo pintado que transmitió el cambio a su descendencia.
El resultado es el primer erizo de mar transgénico, uno que brilla como una bombilla navideña bajo una luz fluorescente. (El artículo ha sido enviado para revisión por pares).
Los animales son los primeros equinodermos transgénicos, el filo que incluye estrellas de mar, pepinos de mar y otros animales marinos. La misión de Hamdoun es hacer que los erizos genéticamente modificados estén disponibles para los investigadores en cualquier lugar, no sólo para aquellos que trabajan en instalaciones de investigación en el borde del Océano Pacífico.
"Si nos fijamos en algunos de los otros organismos modelo, como Drosophila [moscas de la fruta], pez cebra y ratón, hay centros de recursos bien establecidos", dijo Elliot Jackson, investigador postdoctoral en Scripps y autor principal del artículo. "Si quieres una línea transgénica que etiquete el sistema nervioso, probablemente puedas conseguirla. Podrías pedirla. Y eso es lo que esperamos que podamos ser para los erizos de mar".
Ser capaz de modificar genéticamente un animal potencia lo que los científicos pueden aprender de él, con implicaciones que van mucho más allá de cualquier especie individual.
"Transformará a los erizos de mar como modelo para comprender la neurobiología, la biología del desarrollo y la toxicología", afirmó Christopher Lowe, profesor de biología de Stanford que no participó en la investigación.
El avance del laboratorio, y su enfoque en hacer que los animales estén disponibles gratuitamente para otros científicos, "nos permitirá explorar cómo la evolución ha resuelto muchos problemas de la vida realmente complicados", dijo.
Los investigadores tienden a estudiar ratones, moscas y similares no porque la biología de los animales sea la más adecuada para responder a sus preguntas, sino porque "todas las herramientas necesarias para responder a sus preguntas se construyeron en unas pocas especies", dijo Deirdre Lyons. , profesor asociado de biología en Scripps que trabajó con Hamdoun en las primeras investigaciones relacionadas con el proyecto.
Ampliar la gama de animales disponibles para trabajos de laboratorio sofisticados es como agregar colores a la paleta de un artista, dijo Lyons:"Ahora puedes obtener el color que realmente deseas, el que mejor se adapte a tu visión, en lugar de quedarte estancado con unos pocos modelos. "
En la planta baja del edificio de oficinas de Hamdoun se encuentra el acuario experimental Hubbs Hall, un espacio parecido a un garaje repleto de tanques llenos de agua de mar en recirculación y una variada variedad de vida marina.
En una visita reciente, Hamdoun metió la mano en un tanque y suavemente sacó a un pilluelo pintado. Se deslizó con sorprendente velocidad sobre una palma extendida, como si explorara un terreno extraño.
El último ancestro común de L. pictus y Homo sapiens vivió hace al menos 550 millones de años. A pesar de los diferentes caminos evolutivos que hemos recorrido desde entonces, nuestros genomas revelan una herencia biológica compartida.
Las instrucciones genéticas que impulsan la transformación de un único cigoto en un cuerpo vivo son sorprendentemente similares en nuestras dos especies. Los sistemas especializados se diferencian de un único óvulo fertilizado y de la traducción de una mezcla de proteínas en un ser vivo singular; a nivel celular, todo eso ocurre de manera muy similar para los pilluelos y las personas.
Estos animales son "realmente fundamentales para nuestra comprensión de toda la vida", dijo Hamdoun, volviendo a colocar al erizo en su tanque. "E históricamente, genéticamente muy inaccesible."
El acuario experimental se construyó en la década de 1970, cuando extraer vida del mar era la única forma de adquirir especímenes para investigación. Unos pisos más arriba, en Hubbs Hall, Hamdoun abrió el camino hacia el vivero de erizos:el primer esfuerzo a gran escala para criar generaciones sucesivas de animales en un laboratorio. En un momento dado, el equipo tiene entre 1000 y 2000 erizos de mar en distintas etapas de desarrollo.
Fila tras fila de diminutos tanques de plástico se alineaban contra una pared, cada uno de los cuales contenía un erizo juvenil del tamaño de una lenteja. Una tira de cinta adhesiva en cada tanque anotó la modificación genética del animal y la fecha de fertilización. En algunos, un segundo trozo de cinta indicaba animales que tenían la modificación en el ADN de sus células sexuales, lo que significa que podía transmitirse a la descendencia. (Por esta razón, el laboratorio mantiene a sus erizos escrupulosamente separados de la población salvaje).
"Una de las grandes preguntas en toda la biología es entender cómo la serie de instrucciones en el genoma te da cualquier fenotipo que quieras estudiar", dijo Hamdoun; esencialmente, cómo la cadena de aminoácidos que es el código genético de un animal da lugar a a las características de la criatura viviente que respira. "Una de las cosas fundamentales que hay que hacer es poder modificar ese genoma y luego estudiar cuál es el resultado".
Señaló un tanque que contenía un diminuto erizo de cuyo código genético se había extraído la proteína ABCD1.
ABCD1 actúa como un portero, explicó Hamdoun, estacionándose a lo largo de la membrana celular y expulsando moléculas extrañas. La acción de la proteína puede preservar la célula de sustancias nocivas, pero a veces puede ir en contra del mejor interés del organismo, como cuando impide que la célula absorba un medicamento necesario.
Los investigadores que utilizan erizos en los que esa proteína ya no funciona pueden estudiar el movimiento de una molécula a través de un organismo (el DDT, por ejemplo) y medir cuánta sustancia termina en la célula sin la confusa interferencia del ABCD1. Pueden realizar ingeniería inversa sobre el papel que desempeña ABCD1 en la prevención de que una célula absorba un fármaco.
Y luego están los pilluelos fluorescentes.
"La magia sucede en esta sala", dijo Jackson, entrando a una oficina estrecha con microscopios valorados en un millón de dólares en un extremo y una centrífuga manual de décadas de antigüedad atornillada a una mesa en el otro.
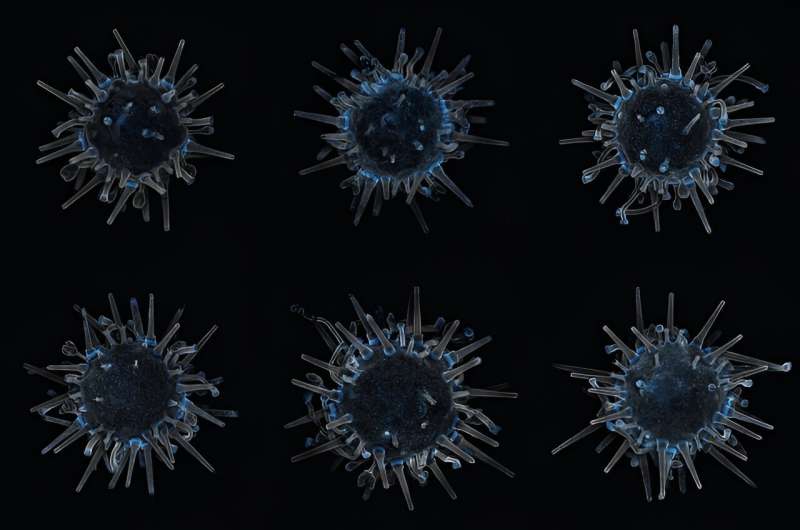
Colocó una placa de Petri que contenía tres erizos transgénicos del tamaño de un borrador de lápiz bajo un microscopio. Con 120 veces su tamaño, cada una parecía la bola de Nochevieja de Times Square hecha realidad:una criatura brillante y ondulante de simetría radial pentámera.
La fluorescencia no es sólo un truco de fiesta de los equinodermos. Iluminar las células facilita a los investigadores seguir su movimiento en un organismo en desarrollo. Los investigadores pueden observar cómo las primeras células de una blástula se dividen y reorganizan en tejido nervioso o cardíaco. Con el tiempo, los científicos podrán desactivar genes individuales y ver cómo eso afecta el desarrollo. Nos ayudará a comprender cómo se desarrolla nuestra propia especie y por qué ese desarrollo no siempre se desarrolla según lo planeado.
El laboratorio "ha hecho un gran trabajo. Ha sido realmente bien recibido por la comunidad", afirmó Marko Horb, científico senior y director del National Xenopus Resource en el Laboratorio de Biología Marina de la Universidad de Chicago.
Horb dirige el centro nacional de intercambio de información sobre especies genéticamente modificadas de Xenopus, una rana con garras utilizada en investigaciones de laboratorio. El centro desarrolla líneas de ranas transgénicas para uso científico y las distribuye a los investigadores.
Hamdoun imagina un centro de recursos similar para los pilluelos de su laboratorio. Ya han comenzado a enviar pequeños viales de esperma de erizo transgénico a los científicos interesados, quienes pueden cultivar erizos a medida con óvulos adquiridos en el laboratorio de Hamdoun o de otra fuente.
Hamdoun recuerda vívidamente el tiempo que pasó al principio de su carrera tratando de rastrear fragmentos aleatorios de ADN necesarios para su investigación, la decepción y frustración de escribir a profesores y ex posdoctorados solo para descubrir que el material se había perdido hacía mucho tiempo. Preferiría que las futuras generaciones de científicos dedicaran su tiempo al descubrimiento.
"La biología es realmente interesante", dijo. "Cuanta más gente pueda acceder a él, más aprenderemos".
Más información: Elliot W. Jackson et al, Transgénesis de línea germinal estable utilizando el elemento marino/MinosTc1 en el erizo de mar, Lytechinus pictus, bioRxiv (2024). DOI:10.1101/2024.03.26.586777
Información de la revista: bioRxiv
2024 Los Ángeles Times. Distribuido por Tribune Content Agency, LLC.