El parásito unicelular Cryptosporidium es una de las principales causas de enfermedades diarreicas mortales en niños pequeños, y un brote reciente en el Reino Unido pone de relieve cuán vulnerable es el suministro de agua a este patógeno.
No existen medicamentos ni vacunas eficaces, lo que lo convierte en un organismo importante para estudiar. El parásito infecta las células que recubren los intestinos y participa en una replicación tanto asexual como sexual, que los investigadores sospechan que son fundamentales para la infección y la transmisión sostenidas.
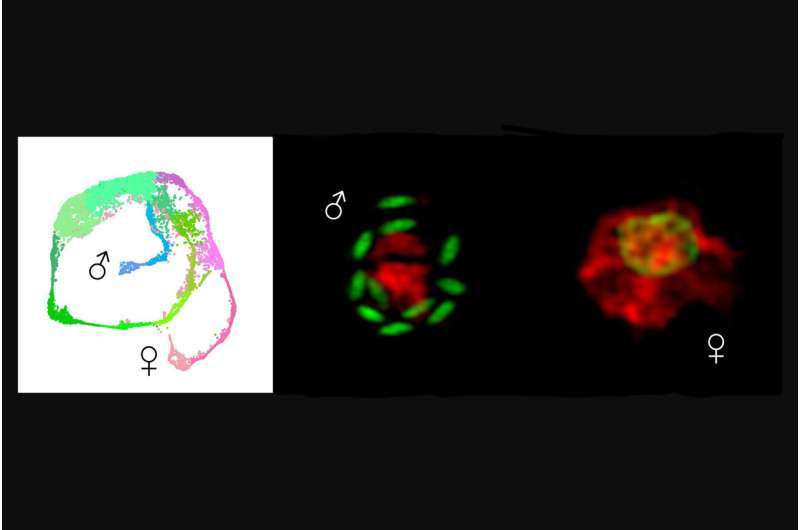
Pero se desconoce el mecanismo por el cual el parásito se vuelve masculino o femenino. "Estos parásitos no tienen cromosomas sexuales, como los humanos X o Y", dice Katelyn A. Walzer, becaria postdoctoral en el Laboratorio Striepen de la Facultad de Medicina Veterinaria de Penn. "Revelar cómo eligen el sexo tiene un interés biológico fundamental y proporciona un nuevo objetivo clave para bloquear la transmisión y la infección".
Walzer es el autor principal de un estudio publicado en Nature. , que revela el programa de expresión genética de todo el ciclo de vida de Cryptosporidium.
Utilizando la secuenciación de ARN, los investigadores perfilaron más de 9.000 parásitos (de cultivos celulares y ratones infectados) y desarrollaron el atlas unicelular de Cryptosporidium, que revela qué genes se expresan y en qué puntos del ciclo de vida.
En un segundo hallazgo importante, los investigadores identificaron el determinante más temprano de la masculinidad, un gen llamado Myb-M.
"En este y otros trabajos demostramos que la parte sexual de este ciclo de vida es fundamental para la infección, y bloquearla mediante anticoncepción parasitaria bloqueará la infección", dice el autor principal Boris Striepen. Dice que al interrumpir el sexo "podemos curar la enfermedad o debilitar el parásito para diseñar una vacuna, por lo que creo que existe un potencial traslacional realmente fuerte".
Esto se basa en investigaciones anteriores que revisaron el ciclo de vida a uno con solo tres etapas (una sola forma asexual, machos y hembras), mientras que la literatura predominante proponía una etapa intermedia adicional.
Walzer explica que Cryptosporidium infecta a las personas, a menudo a través de agua contaminada, en una forma parecida a una espora llamada ooquiste, que es resistente a la cloración del agua. Una vez en el intestino, los parásitos emergen de las esporas para invadir las células epiteliales que recubren el intestino y se replican dentro de esas células antes de salir e invadir nuevas células intestinales.
Este ciclo asexual de invasión, replicación y salida ocurre tres veces antes de que los parásitos se diferencien en gametos masculinos y femeninos, y luego la fertilización conduce a nuevos ooquistes.
Walzer dice que, a través de esta nueva investigación, "tenemos una comprensión completa de todos los genes que están involucrados en cada uno de esos procesos, desde la invasión hasta el crecimiento, la división y luego volver a formar la forma invasiva".
Ella dice que este atlas ofrece un modelo detallado de cada aspecto de la biología del parásito y sus vulnerabilidades potenciales. Cryptosporidium produce muchas proteínas que son necesarias para invadir y manipular al huésped, y el trabajo del equipo analiza estas diferentes proteínas en función del momento en que se leen sus genes.
"Las formas invasivas del parásito vienen con una batería de armas que les permiten invadir y alcanzar nuestras células, y este arsenal está ensamblado con una precisión temporal notable", dice Striepen. Lo compara con la línea de montaje de una fábrica de automóviles donde los nuevos componentes se fabrican justo a tiempo, y Walzer ha desarrollado una lista de todas las piezas y cuándo se ensamblan.
Walzer dice que los investigadores en este campo están entusiasmados con el atlas unicelular de Cryptosporidium porque pueden buscar el contexto en el que se expresan los genes que están estudiando. Esta es información muy útil para quienes buscan objetivos farmacológicos y vacunas, ya que ayuda a predecir las fases de la infección en las que el parásito puede ser más vulnerable.
Al diseñar parásitos para que expresen fluorescencia, los investigadores también llegaron a su segundo hallazgo clave:el descubrimiento del factor de transcripción, es decir, una proteína que regula la expresión genética, responsable de la masculinidad, Myb-M.
"Cuando forzamos al parásito a producir este factor en cualquier momento, todos y cada uno de los parásitos se volvieron masculinos, y cuando lo eliminamos, no se desarrolló ningún macho. Es importante destacar que ambas manipulaciones bloquearon la infección", dice Walzer.
Striepen dice que este hallazgo subraya el valor del sexo de los parásitos como objetivo de intervención, y Walzer dice que este estudio también "nos lleva a conocer el catálogo completo de genes necesarios para el sexo de los parásitos, proporcionando pistas importantes sobre el mecanismo y los objetivos traslacionales". P>
Walzer dice que en investigaciones futuras está interesada en hacer un seguimiento de cómo Myb-M impulsa el destino masculino y en comprender de manera más general cómo la regulación de la transcripción impulsa diferencias específicas de etapas para orquestar el complejo ciclo de vida.
Más información: Katelyn A. Walzer et al, Control transcripcional del ciclo de vida de Cryptosporidium, Naturaleza (2024). DOI:10.1038/s41586-024-07466-1
Información de la revista: Naturaleza
Proporcionado por la Universidad de Pensilvania