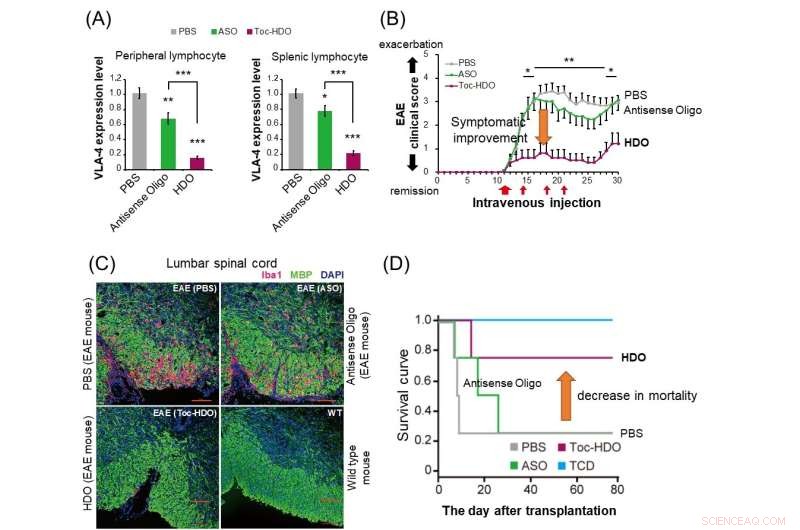
(A) En ratones normales, la administración de HDO (barra roja) suprime más drásticamente la expresión del gen de la integrina α4β1 en linfocitos periféricos y esplénicos en comparación con el oligonucleótido antisentido (barra verde). (B) En ratones con encefalomielitis autoinmune experimental (EAE), la administración de HDO dirigida a la integrina α4β1 después del inicio de los síntomas ha mostrado una mejora en la puntuación clínica. (C) La administración de HDO dirigida a la integrina α4β1 antes del inicio de los ratones EAE da como resultado una infiltración de células inflamatorias positivas para Iba1 reducida (rojo) y una mejor desmielinización (verde) en la médula espinal lumbar. (D) En el modelo de ratón de injerto versus -enfermedad del huésped (GVHD), el trasplante de células T derivadas del bazo junto con células de la médula ósea después del tratamiento con HDO dirigida a la integrina α4β1 mejoró la curva de supervivencia. TCD:Células de médula ósea trasplantadas sin células T derivadas del bazo. Crédito:Departamento de Neurología y Ciencias Neurológicas, TMDU
Los linfocitos T y B, que son parte de un grupo de células inmunitarias comúnmente llamadas glóbulos blancos, trabajan juntos para eliminar a los invasores extraños en el cuerpo, como los virus. Sin embargo, ciertas enfermedades pueden surgir cuando las células T y B se activan en momentos inapropiados, incluidos los trastornos autoinmunes y varios tipos de cáncer. En un artículo reciente publicado en Nature Communications , un equipo dirigido por investigadores de la Universidad Médica y Dental de Tokio (TMDU) describe una tecnología llamada oligonucleótido heterodúplex (HDO) que desarrollaron para administrar a los linfocitos y regular sus funciones.
La expresión génica está en la raíz del control de la actividad celular. La enfermedad puede resultar cuando ciertos genes se desactivan incorrectamente o se expresan sin control. Por lo tanto, los científicos se han propuesto desarrollar métodos terapéuticos para restaurar los niveles de expresión génica a su estado saludable, idealmente solo en las células anormales. Una de esas modalidades es la entrega de moléculas de ADN o ARN diseñadas específicamente que pueden localizar los mensajes genéticos mal expresados y dirigir a la célula para que los reduzca a niveles normales. Sin embargo, la parte más difícil de esto es garantizar que las moléculas terapéuticas puedan llegar de manera eficiente a su destino adecuado sin que la célula las degrade.
"Nuestro equipo diseñó una molécula híbrida de ADN/ARN llamada HDO", dice el autor principal del estudio, Masaki Ohyagi. "La secuencia específica de HDO se puede modificar para dirigirse a un gen de interés en particular, mientras que su columna vertebral lo hace estable dentro de las células".
Una parte clave del diseño de HDO del equipo es la adición de una molécula llamada α-tocoferol, que es crucial para su correcta administración. Debido a que el α-tocoferol es esencial para las respuestas inmunitarias linfocíticas adecuadas, agregarlo permite que el HDO se administre en la sangre periférica y se dirija a los linfocitos. El equipo diseñó HDO para varios genes de ratón y luego los inyectó por vía intravenosa en ratones de laboratorio.
"Descubrimos que nuestra tecnología HDO podía silenciar específicamente estos genes en linfocitos de ratón de manera más robusta y estable, y también con menos toxicidad, que otras versiones anteriores de este método", afirma Takanori Yokota, autor principal del artículo. "Nuestros estudios también mostraron que las HDO ingresan a estas células a través de un proceso llamado endocitosis".
Después de descubrir que su tecnología era efectiva para silenciar genes, el equipo de TMDU investigó si podría ser útil como tratamiento de enfermedades. Diseñaron un HDO dirigido a un gen llamado Itga4, que es fundamental para la patogenia de la encefalomielitis autoinmune experimental (EAE), un modelo de ratón para la esclerosis múltiple (EM).
"La inyección intravenosa de HDO dirigida a Itga4 en estos ratones retrasó el inicio y mejoró los síntomas de EAE y redujo tanto la infiltración de células inflamatorias como la desmielinización de la médula espinal", explica Ohyagi.
Este trabajo demuestra los poderosos efectos de silenciamiento de genes de la tecnología HDO, así como sus capacidades de administración superiores en relación con otros métodos similares. Lo más significativo es que el HDO específico de Itga4 pudo mejorar los resultados en un modelo de ratón con EM, lo que sugiere que puede ser útil como una nueva terapia que podría desarrollarse para enfermedades humanas mediadas por el sistema inmunitario.