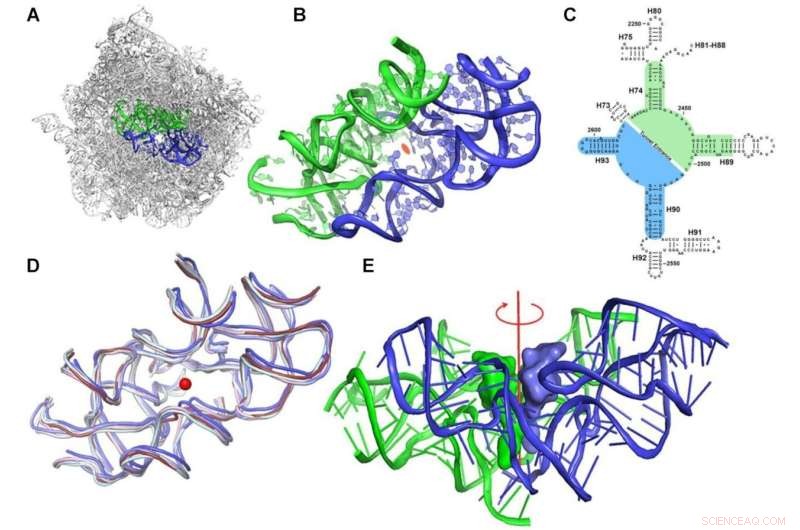
El concepto de protorribosoma. (A) La región simétrica, marcada en azul (A-reg) y verde (P-reg), dentro del andamio de ARNr de la subunidad ribosómica grande de D. radiodurans (PDBID 1NKW). (B) Un primer plano del protoribosoma donde se muestran las partes semisimétricas dobles. La vista es a lo largo del eje doble de pseudosimetría. El centro del PTC está marcado por una elipse naranja. (C) Un diagrama de estructura bidimensional del rRNA que rodea el PTC que representa la simetría. Los nucleótidos A- y P-reg están marcados con fondos azules y verdes, respectivamente. Los números de hélices de ARNr 23S están marcados en etiquetas negras. Se muestra la numeración de nucleótidos según E. coli. (D) Superposición de la región simétrica de estructuras de ribosomas de varios organismos representativos de varias clases filogenéticas:bacteriano (D. radiodurans y E. coli en pizarra y azul claro, respectivamente), levadura (S. cerevisiae en cian pálido), parásito ( L. donovani en azul) y ribosomas humanos (citosólicos y mitocondriales en rubí y rosa claro, respectivamente) (los PDBID utilizados son:1NKW, 4V4Q, 4V7R, 3JCS, 4U60 y 3J7Y, respectivamente). El punto rojo central representa la posición del supuesto eje de simetría, que es perpendicular al plano. (E) El extremo CCA-3' del sitio A y los ARNt del sitio P se superpusieron en la región simétrica del ribosoma bacteriano (PDBID 1NKW). La vista es perpendicular al eje doble semisimétrico, que se muestra en rojo. Crédito:Investigación de ácidos nucleicos (2022). DOI:10.1093/nar/gkac052
Esta historia comienza hace varios miles de millones de años. Solo hay química, no biología, es decir, existen muchos compuestos químicos en la Tierra, pero la vida aún no ha surgido. Luego, entre miríadas de estructuras químicas autoensambladas al azar, una diminuta máquina molecular de ARN se revela como perfectamente adecuada para crear enlaces entre aminoácidos activados, los componentes básicos de futuras proteínas.
Es un punto de inflexión en la historia de nuestro planeta:ahora puede comenzar la síntesis de proteínas, moléculas biológicas esenciales para la vida. La profesora Ada Yonath y su equipo del Instituto de Ciencias Weizmann creen que han recreado ese momento en el laboratorio, mostrando cómo podría haber sucedido. En cuanto a la máquina primordial de creación de enlaces peptídicos, descubrieron que todavía está presente en prácticamente todas las células de todos los organismos vivos, desde bacterias hasta plantas y animales, incluidos nosotros mismos.
La teoría detrás del proyecto del equipo nació hace unos 20 años a partir de sorprendentes hallazgos realizados en el laboratorio de Yonath en el curso de la determinación de la estructura y función del ribosoma, investigación que luego le valdría el Premio Nobel de Química 2009. El ribosoma lleva a cabo uno de los procesos fundamentales de la vida:fabricar proteínas basándose en la información del ADN.
"Descubrimos una característica sorprendente en la estructura de esta máquina productora de proteínas", dice la Dra. Anat Bashan, científica senior del laboratorio de Yonath en el Departamento de Biología Química y Estructural de Weizmann. "El ribosoma es una macromolécula enorme que no es en absoluto simétrica; en su corazón, contiene dos elementos semisimétricos unidos para formar un bolsillo".
Yonath dice que "les sorprendió especialmente el hecho de que este bolsillo se encuentra en los ribosomas de todos los organismos. Y aquí es donde tiene lugar toda la acción:es donde se unen todos los péptidos que crean la cadena de aminoácidos enlazados que forman una proteína". se forman. Es por eso que esta maquinaria básica parece haber persistido sin cambios a lo largo de la evolución".
Conozca el protoribosoma:así es como los científicos llaman a esta estructura en forma de bolsillo. Ellos plantearon la hipótesis de que el protoribosoma es el antepasado de todos los ribosomas modernos, una máquina antigua que data del período anterior a la vida. En comparación con el tamaño de la célula, el protoribosoma es bastante pequeño. Consiste en moléculas de ARN que comprenden unos 120 nucleótidos, unos 60 para cada uno de sus dos componentes semisimétricos, lo que representa menos del 5 por ciento de las dimensiones del ribosoma moderno:unos 4500 nucleótidos en bacterias y casi 6000 en humanos
Así es como se desarrolló el escenario, según Yonath y su equipo:
El protoribosoma surgió cuando un grupo de cadenas de nucleótidos de ARN se autoensamblaron en dos paredes semisimétricas que se unieron para crear un bolsillo. Un sinfín de otras estructuras deben haberse autoensamblado accidentalmente al mismo tiempo, pero el protoribosoma sobrevivió, "volviéndose viral", al parecer, porque realizó funciones útiles y, gracias a las capacidades intrínsecas del ARN, pudo autorreplicarse.
Cuando dos aminoácidos activados interactuaron entre sí dentro de este bolsillo, formaron un enlace, facilitado por las condiciones químicas predominantes. Esos aminoácidos pueden haber surgido en la Tierra o, como algunos argumentan, aterrizar con asteroides del espacio exterior, pero su origen es irrelevante para nuestra historia. Lo que importa es que dentro del protoribosoma, dos aminoácidos activados podrían unirse entre sí. Más tarde, dicha formación de enlaces unió muchos más aminoácidos, uniéndolos en una cadena.
Ese fue el comienzo de las proteínas, algunas de las cuales luego resultaron útiles para estabilizar y reforzar el propio protoribosoma. Las proteínas siguieron añadiéndose a la estructura del protoribosoma, lo que le permitió evolucionar hasta convertirse en la sofisticada fábrica de proteínas que es hoy. "Un ribosoma moderno se puede describir como una cebolla, con el protoribosoma en el centro, rodeado de más capas que se agregaron durante la evolución", dice Yonath.
Con el tiempo, la producción de proteínas sería lo suficientemente eficiente como para crear cadenas de hasta miles de aminoácidos de longitud, y hacerlo de acuerdo con las instrucciones escritas en el código genético. Las decenas de miles de proteínas en el cuerpo humano realizan diferentes funciones, desde hormonas como la insulina, hasta anticuerpos en el sistema inmunológico, hasta componentes estructurales de células y tejidos como la hemoglobina o el colágeno de la piel. Y todos comenzaron con los enlaces que alguna vez se formaron por casualidad dentro del protoribosoma.
Avance rápido unos pocos miles de millones de años. La teoría había sido confirmada por cálculos, deducciones y experimentos de dimerización, en los que los científicos crearon construcciones diméricas de ARN, imitando al protoribosoma propuesto. Pero hasta hace poco, los principios de la teoría seguían siendo, bueno, en gran parte teóricos. Ahora, en un nuevo estudio dirigido por la becaria postdoctoral Dra. Tanaya Bose en el laboratorio de Yonath, los científicos le han brindado apoyo experimental.
Bose y sus colegas se propusieron explorar si un protoribosoma sintetizado en el laboratorio sería lo suficientemente estable para sobrevivir y realizar su supuesta formación de enlaces, es decir, querían averiguar si realmente era capaz de realizar esta tarea. Ella y los otros miembros del equipo de Yonath crearon un diseño para un protoribosoma potencial mediante el análisis de las estructuras en forma de bolsillo en el corazón de varios ribosomas bacterianos. Luego, Bose preparó estas construcciones protorribosómicas en una placa de laboratorio.
Luego vino el paso crucial:verificar si las construcciones de dímeros en forma de bolsillo podrían crear enlaces entre los aminoácidos. Después de mezclar las construcciones con una solución que contenía sustratos de aminoácidos activados, así como varias sales y otros reactivos, Bose sometió los productos de la reacción a una serie de pruebas, incluido el análisis de espectrometría de masas.
Para deleite del equipo, los protorribosomas sintéticos creados en el laboratorio estuvieron a la altura de la tarea. "La formación de enlaces peptídicos es la actividad más vital en cualquier célula y hemos demostrado que puede tener lugar dentro de un protoribosoma", dice Bose.
"El protoribosoma propuesto podría ser el eslabón perdido entre un mundo dominado por el ARN, que puede haber existido antes de que aparecieran las proteínas y el ADN, y la vida basada en proteínas y ácidos nucleicos, tal como la conocemos hoy", dice Bashan.
La investigación fue publicada en Nucleic Acids Research . Lazos del pasado:un viaje por la historia de la síntesis de proteínas