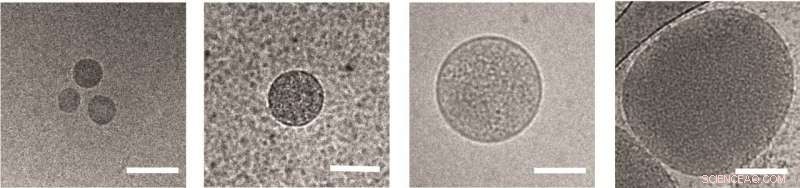
Nanovesículas liberadas de glóbulos rojos infectados por Plasmodium falciparum , visto bajo un microscopio electrónico. Barra de escala:100 nm Crédito:Instituto de Ciencias Weizmann
Los esfuerzos mundiales para erradicar la malaria dependen fundamentalmente de la capacidad de los científicos para burlar al parásito de la malaria. Y Plasmodium falciparum es notoriamente inteligente:desarrolla rápidamente resistencia a los medicamentos y tiene un ciclo de vida tan complejo que bloquearlo eficazmente con una vacuna ha resultado difícil de alcanzar. En un nuevo estudio informado en Comunicaciones de la naturaleza , investigadores del Instituto de Ciencias Weizmann, junto con colaboradores en Irlanda y Australia, han demostrado que Plasmodium falciparum es incluso más tortuoso de lo que se pensaba anteriormente:no solo se esconde de las defensas inmunitarias del cuerpo, emplea una estrategia activa para engañar al sistema inmunológico.
Entre las enfermedades transmisibles, la malaria ocupa el segundo lugar después de la tuberculosis en el número de víctimas, poniendo en riesgo a casi la mitad de la población de la Tierra. Más de 200 millones de personas se infectan cada año; alrededor de medio millón muere, la mayoría de ellos niños menores de cinco años. "La malaria es una de las enfermedades más devastadoras del mundo; es una verdadera pesadilla para los países de bajos ingresos, donde mata a mil niños pequeños todos los días, "dice el Dr. Neta Regev-Rudzki del Departamento de Ciencias Biomoleculares de Weizmann." Para combatir la malaria, necesitamos entender la biología básica de Plasmodium falciparum y descubrir qué lo convierte en un asesino tan peligroso ".
Regev-Rudzki había descubierto previamente, en sus estudios postdoctorales en el laboratorio del Prof. Alan Cowman en el Instituto de Investigación Médica Walter and Eliza Hall en Melbourne, Australia, que estos parásitos se comunican entre sí mientras se encuentran en la etapa de incubación en la sangre. Lo hacen liberando nanovesículas en forma de saco, de menos de 1 micra de diámetro, que contienen pequeños segmentos del ADN del parásito. Aparentemente, estas señales ayudan a los parásitos a aprender cuándo es el momento de comenzar a transformarse en formas masculinas y femeninas. ambos pueden ser transportados por mosquitos a nuevos huéspedes. Este hallazgo fue aún más sorprendente porque las nanovesículas necesitan cruzar seis membranas separadas para comunicar el mensaje de un parásito dentro de un glóbulo rojo a otro.
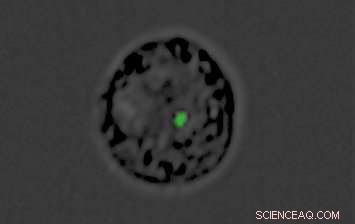
Un monocito convertido en señuelo por el parásito de la malaria:el punto verde es la "carga" de material genético dentro de la nanovesícula producida por el parásito. Crédito:Instituto de Ciencias Weizmann
En el nuevo estudio, realizado en colaboración con el Prof. Andrew G. Bowie del Trinity College Dublin y otros investigadores, Regev-Rudzki y su equipo de Weizmann descubrieron que, en paralelo con la comunicación con otros parásitos, Plasmodium falciparum utiliza este mismo canal de comunicación para otro propósito:enviar un mensaje engañoso al sistema inmunológico de la persona infectada. Dentro de las primeras 12 horas después de infectar los glóbulos rojos, los parásitos envían nanovesículas llenas de ADN que penetran en células llamadas monocitos. Normalmente, los monocitos forman la primera línea de defensa del sistema inmunológico contra la invasión extranjera, detectar el peligro desde lejos y alertar a otros mecanismos inmunitarios para montar una respuesta eficaz. Naturalmente, el sistema inmunológico envía su siguiente línea de defensa a estas células.
Pero, de hecho, las nanovesículas han convertido a los monocitos en señuelos. Mientras el sistema inmunológico está ocupado defendiendo al organismo contra un peligro falso, la infección real procede dentro de los glóbulos rojos, permitiendo que el parásito se multiplique sin obstáculos a una velocidad vertiginosa. Para cuando el sistema inmunológico descubre su error, se ha perdido un tiempo precioso, y la infección es mucho más difícil de contener.
El equipo de Regev-Rudzki ha identificado un sensor molecular clave, una proteína llamada STING que se activa cuando las nanovesículas del parásito penetran en los monocitos. Es STING el que envía la alerta falsa al sistema inmunológico, engañándolo para que "piense" que sus monocitos están en peligro. Cuando los científicos "eliminaron" el gen que fabrica STING, se interrumpió la cadena de reacciones moleculares que generaban la alerta engañosa.
"Hemos descubierto una estrategia subversiva que emplea el parásito de la malaria para prosperar en la sangre humana, "Dice Regev-Rudzki." Al interferir con esta subversión del sistema inmunológico, es posible que en el futuro se desarrollen formas de bloquear la infección por malaria ".