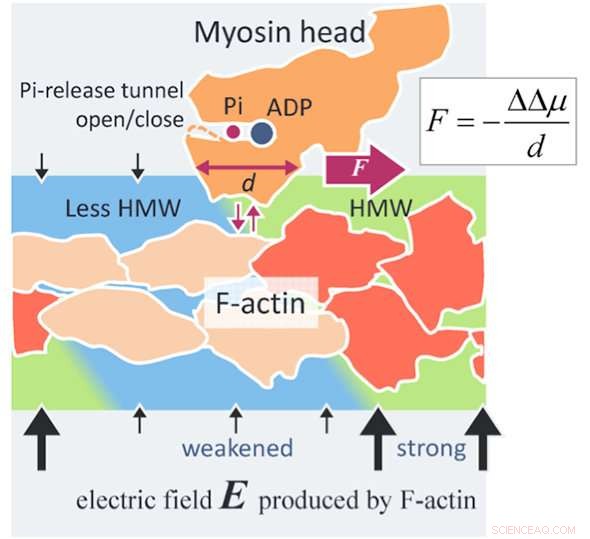
Un nuevo mecanismo de generación de fuerza de la actomiosina. Un filamento de actina (F-actina) produce un campo eléctrico (flechas negras) tan alto como 100 MV / m alrededor de F-actina debido a sus cargas superficiales negativas. Las moléculas de agua en un campo eléctrico tan alto se convierten en moléculas de agua hipermóviles (HMW, verde claro) en las proximidades de F-actina. Por otra parte, El ATP en solución se une con una cabeza de miosina (naranja) y se divide en difosfato de adenosina (ADP) y fosfato inorgánico (Pi) en la cabeza. Cuando la cabeza de miosina con ADP y Pi se une con F-actina (rojo anaranjado), varias subunidades de actina cambian sus estructuras (beige). Luego, la intensidad del campo eléctrico disminuye alrededor de estas subunidades de actina modificadas y la intensidad de HMW también disminuye (azul claro) para acercarse al agua libre. En el presente estudio, se ha encontrado que el estado de hidratación de la proteína es más estable en la región HMW más fuerte. En la figura, la cabeza de miosina se conduce hacia la derecha donde la intensidad de HMW es más fuerte (verde claro), con la separación de F-actina y unir de nuevo con F-actina. La fuerza evaluada por el presente método es tan alta como varios piconewtons, que está al nivel de los valores experimentales. Este puede ser un principio de fuerza superficial novedosa que actúa entre una macromolécula cargada, como proteínas y ADN, y una proteína soluto ampliamente aplicable a la ciencia y la tecnología. Crédito:Makoto Suzuki
El complejo de actina y miosina (actomiosina) genera la fuerza de contracción de un músculo utilizando la reacción de hidrólisis de trifosfato de adenosina (ATP). Por tanto, se han realizado muchos intentos para explicar el origen molecular de la motilidad de la actomiosina.
Un modelo de golpe de potencia de miosina, propuesto por Huxley y Simmons en 1971, inició muchas investigaciones, incluidos estudios de estructura atómica y la investigación de la biología molecular de las moléculas de miosina y actina. El modelo de carrera de potencia, modificado últimamente, se adopta ampliamente en los libros de texto estándar de biología.
Sin embargo, sigue existiendo un problema grave. Según los datos de termodinámica experimental, la hidrólisis de ATP en la cabeza de miosina no produce un estado de miosina con suficiente energía para generar la fuerza de contracción.
Ahora, un grupo de investigación, dirigido por el profesor emérito Makoto Suzuki en la Universidad de Tohoku en colaboración con el profesor Nobuyuki Matubayasi en la Universidad de Osaka, ha logrado explicar el mecanismo impulsor de la actomiosina de acuerdo con los datos termodinámicos experimentales.
En el estudio, la estructura del agua en las proximidades de un filamento de actina (F-actina) se modifica al unirse con una cabeza de miosina que hidroliza el ATP a F-actina, que conduce a un cambio en la afinidad a la cabeza de miosina y por lo tanto a la generación de la fuerza impulsora de actomiosina.
La presencia de la nueva fuerza de superficie intermolecular, que se demostró por primera vez con base en los análisis de hidratación actuales, fue un descubrimiento notable. Este artículo es, por lo tanto, el primero en desvelar con éxito el mecanismo de accionamiento de la actomiosina mediante la introducción de una nueva fuerza de superficie intermolecular.