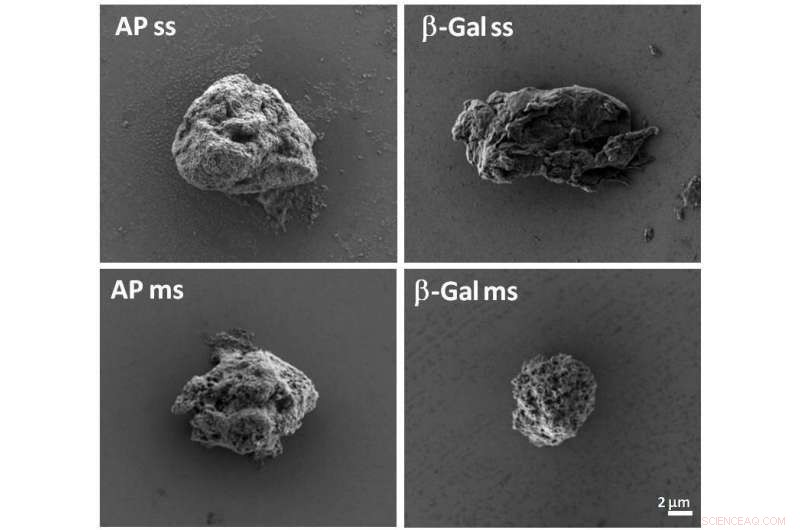
Cuerpos de inclusión artificiales. Crédito:CIBER-BBN, UAB, IR Sant Pau
La medicina de precisión es cada vez más importante, creando terapias personalizadas más eficientes para cada paciente y desarrollos farmacológicos innovadores. En el campo de la oncología, por ejemplo, los investigadores están desarrollando diferentes enfoques dirigidos a sistemas de liberación de fármacos dirigidos y controlados, disminuyendo así la toxicidad para el organismo.
En este sentido, investigadores de Bioingeniería del CIBER, Sector de Biomateriales y Nanomedicina (CIBER-BBN), el Instituto de Biotecnología y Biomedicina de la Universitat Autònoma de Barcelona (IBB-UAB) y el Instituto de Investigación Hospital Sant Pau han desarrollado un nuevo tipo de biomaterial proteico capaz de una liberación sostenida de proteínas terapéuticas administradas por vía subcutánea en animales de laboratorio.
"Estas estructuras, midiendo unos pocos micrómetros de diámetro, contienen proteínas funcionales que se liberan de manera similar a como el sistema endocrino libera las hormonas humanas, "afirma Antonio Villaverde, investigador de la UAB y del CIBER-BBN y uno de los coordinadores del estudio.
El estudio es fruto de una colaboración científica estable entre el grupo de Antonio Villaverde y el grupo que dirige Ramon Mangues en el Instituto de Investigación Hospital Sant Pau. También contó con la participación del Instituto de Investigaciones Biológicas y Tecnológicas de la Universidad Nacional de Córdoba-CONICET en Argentina.
Dr. Mangues, también investigador del CIBER-BBN y coautor del artículo, explica que "el nuevo biomaterial imita un producto bacteriano que se encuentra comúnmente en los procesos biotecnológicos conocidos como 'cuerpos de inclusión, 'que sean de interés farmacológico, y que en esta versión artificial ofrecen un amplio abanico de posibilidades terapéuticas para el campo oncológico y cualquier otro sector clínico en el que se necesite una liberación sostenida ”.
Los investigadores utilizaron como modelos enzimas comunes a la biotecnología y una toxina bacteriana nanoestructurada dirigida a las células metastásicas del cáncer colorrectal humano. que han sido probados en modelos animales. "De este modo, pudimos generar tantos catalizadores inamovibles un nuevo fármaco antitumoral con acción prolongada, "explican los principales autores del estudio.
Enorme potencial clínico
Los gránulos de proteína artificial desarrollados aquí, que se habían propuesto anteriormente como "nanopíldoras" (píldoras terapéuticas a escala nanoscópica), imitan la acción de los cuerpos de inclusión bacterianos y tienen un enorme potencial clínico para las vacunas y los sistemas de administración de fármacos de liberación controlada.
"Hemos visto que los cuerpos de inclusión naturales, administrado como drogas, puede producir respuestas indeseables del sistema inmunológico debido a la inevitable contaminación de los materiales bacterianos, "afirman los investigadores. Sin embargo, en este nuevo estudio, el desarrollo de cuerpos de inclusión artificiales con capacidad de secreción "evita muchos de los problemas regulatorios asociados con el desarrollo potencial de nanopíldoras bacterianas, 'y ofrece una plataforma transversal a través de la cual obtener componentes funcionales para usos cosméticos y clínicos, " agregan.
Este estudio sugiere que los cuerpos de inclusión artificiales pueden convertirse en una nueva categoría de biomateriales explotables para ser utilizados en aplicaciones biotecnológicas. por la facilidad con la que se fabrican y la previsión de futuras aplicaciones clínicas.