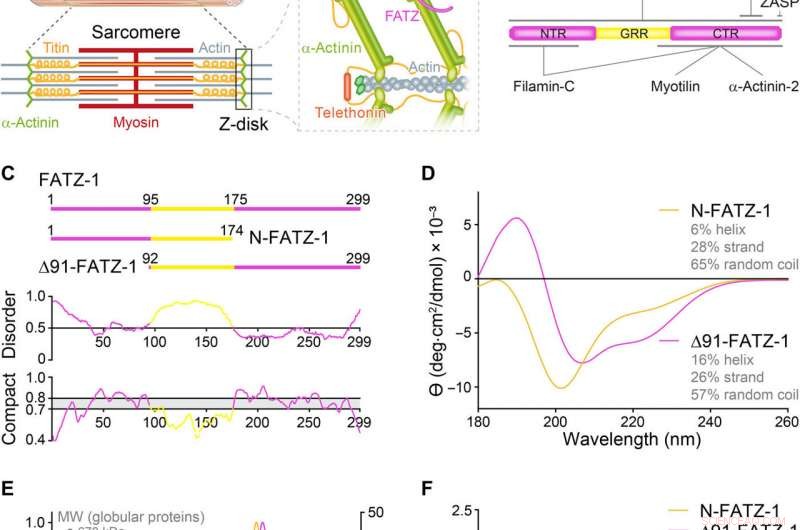
Las proteínas de la familia FATZ presentan un trastorno intrínseco. (A) Esquemas del sarcómero del músculo estriado y vista de cerca de las interacciones F-actina / α-actinina / FATZ en el disco Z. (B) Esquemas del interactoma FATZ-1 y sitios de unión informados hasta la fecha. (C) Esquemas de las principales construcciones FATZ-1, junto con sus límites de aminoácidos y composición de dominios. Las regiones desordenadas previstas (por encima de 0,5) y la compacidad (por encima de 0,8) se muestran a continuación. (D) Espectros de dicroísmo circular (CD) de N-FATZ-1 y Δ91-FATZ-1, junto con el contenido calculado de la estructura secundaria. (E) Cromatografía de exclusión por tamaño (SEC):análisis de dispersión de luz de múltiples ángulos (MALS) de N-FATZ-1 y Δ91-FATZ-1, produciendo pesos moleculares (MW) de 21 y 24 kDa, respectivamente. Los volúmenes de elución fueron inferiores a los previstos en relación con los estándares globulares [tiroglobulina (670 kDa), γ-globulina (158 kDa), ovoalbúmina (44 kDa), y mioglobina (17 kDa)], correspondientes a MW de 50 y 46 kDa para N-FATZ-1 y Δ91-FATZ-1, respectivamente. UV, ultravioleta. (F) Gráficos de Kratky adimensionales de N-FATZ-1 y Δ91-FATZ-1, así como de albúmina de suero bovino globular (BSA) (código SASBDB SASDFQ8). SEC experimental:datos de dispersión de rayos X de ángulo pequeño (SAXS) de N-FATZ-1 (G) y Δ91-FATZ-1 (I) y ajuste correspondiente a los datos de conjuntos seleccionados obtenidos del Método de optimización de conjuntos (EOM). Las distribuciones Rg de conjuntos seleccionados en relación con la distribución de un grupo aleatorio se muestran en los recuadros. Representantes modelo de los conjuntos EOM seleccionados para N-FATZ-1 (H) y Δ91-FATZ-1 (J), junto con su Rg (en nanómetros) y fracciones de volumen (en porcentaje). Crédito:Science Advances, doi:10.1126 / sciadv.abg7653
La alfa-actinina puede reticular los filamentos de actina y anclarlos al disco Z en los sarcómeros. Los sarcómeros son una unidad estructural de las miofibrillas en el músculo estriado. El FATZ (filamin, La proteína de unión a α-actinina y teletonina del disco Z) puede interactuar con la α-actinina y otras proteínas centrales del disco Z que contribuyen al ensamblaje y mantenimiento de las miofibrillas. En un nuevo informe ahora en Avances de la ciencia , Antonio Sponga y un equipo de investigación internacional en Austria, Alemania, Rusia, Polonia y el Reino Unido detallaron la primera estructura y validación celular del complejo α-actinina-2 con un socio de disco Z, FATZ-1, para formar un conjunto conforme. El FATZ-1 formó un complejo difuso apretado con α-actinina-2 con un mecanismo de interacción propuesto a través de elementos de reconocimiento molecular y sitios de unión secundarios. El modelo integrador obtenido reveló una arquitectura polar del complejo en combinación con la función de andamio multivalente FATZ-1 para organizar a los socios de interacción y estabilizarlos.
Sarcómero
Los músculos que se contraen pueden regular el movimiento animal voluntario y los latidos involuntarios del corazón. y los sarcómeros son las unidades contráctiles básicas de las células musculares estriadas. Se componen de matrices de filamentos delgados (actina) y gruesos (miosina) que se deslizan uno al lado del otro durante la contracción. El disco Z puede formar el límite entre sarcómeros adyacentes, donde se anclan filamentos de actina antiparalelos. Debe generarse una estructura de anclaje adecuadamente estable mediante la interacción entre miosina y actina. El disco Z puede cumplir esta función actuando como un centro mecánico y una plataforma de señalización para permitir la transmisión de tensión durante la contracción y la duración y transmisión de información de estrés biomecánico. Como resultado, cualquier mutación que altere la arquitectura y la función del disco Z podría causar disfunción esquelética y cardíaca.
El complejo proteico
La alfa-actinina es una proteína de reticulación de F-actina en los discos Z del músculo, que forma un componente principal del disco Z que reticula los filamentos de actina antiparalelos de los sarcómeros adyacentes para servir como plataforma de unión para múltiples proteínas del disco Z, incluido FATZ-1. Las proteínas FATZ pueden unirse a la α-actinina a través de su región c-terminal y a los dominios de los miembros de la familia Enigma a través de un motivo de reconocimiento c-terminal específico. En este trabajo, Antonio Sponga y col. demostraron cómo las proteínas FATZ contenían regiones intrínsecamente desordenadas (IDR) descritas mejor como un conjunto conformacional, que son menos estables y carecen de una estructura terciaria estable. Además de los métodos de caracterización biofísica, el equipo utilizó cristalografía de rayos X y dispersión de rayos X de ángulo pequeño para describir un complejo de α-actinina-2 / FATZ-1 "difuso". La proteína FATZ-1 puede desempeñar un papel organizativo en el disco Z debido a sus propiedades de andamiaje multivalente y formar un complejo estrecho de arquitectura polar con α-actinina-2.
FATZ-1 forma un complejo compacto 2:1 con dímero de α-actinina-2 a través de múltiples sitios de unión. (A) Esquemas de las construcciones de α-actinina-2, junto con sus límites de aminoácidos y composición de dominios. Análisis SEC-MALS para la interacción de FATZ-1, FATZ-2, y FATZ-3 con α-actinina-2 (B), N-FATZ-1 con varilla-α-actinina-2 (C), Δ91-FATZ-1 con hd-α-actinina-2 (D), y cincoE Δ91-FATZ-1 mutante con α-actinina-2 (E). Análisis ITC para la interacción de Δ91-FATZ-1 con α-actinina-2 (F), N-FATZ-1 con varilla-α-actinina-2 (G), Δ91-FATZ-1 con hd-α-actinina-2 (H), y cincoE Δ91-FATZ-1 mutante con α-actinina-2 (I). Dakota del Norte., no determinado. (J) Relación de intensidad de señal HSQC 1H-15N de 15N Δ91-FATZ-1 unido / libre, mapeo del sitio de unión primario FATZ-1 para α-actinina-2. La parte no asignada en FATZ-1 está en caja, y los residuos se representan en una posición aleatoria. (K) Secuencia de FATZ-1 que muestra múltiples sitios de interacción para α-actinina-2 según se determina a partir de la matriz de péptidos (residuos al cuadrado), XL-MS (estrella), LP-MS (residuos delimitados por flechas), y RMN (flechas). Los residuos que coinciden con el péptido señal más fuerte en la matriz de péptidos se muestran en negrita. Los límites de Δ91-FATZ-1 y mini-FATZ-1 están delimitados por flechas. Las mutaciones dentro de cinco E Δ91-FATZ-1 y RRE Δ91-FATZ-1 se indican en naranja y cian oscuro, respectivamente. Crédito:Science Advances, doi:10.1126 / sciadv.abg7653 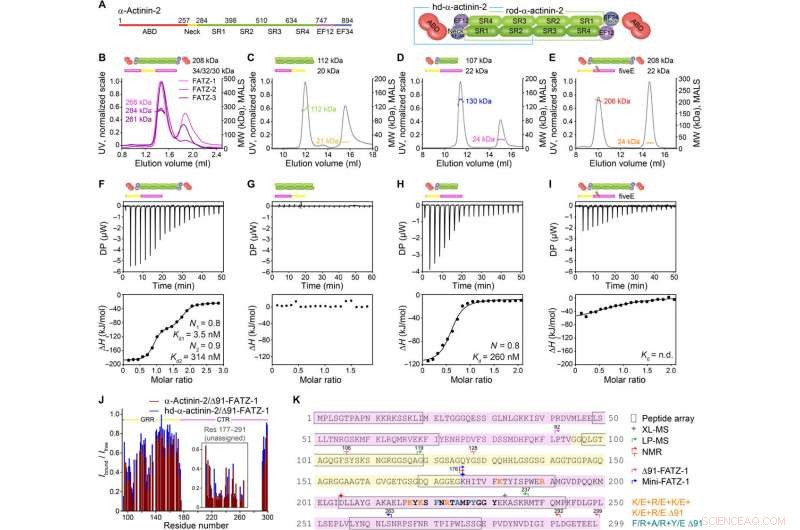
La familia de proteínas FATZ se encuentra en todos los vertebrados donde la FATZ-1 humana, FATZ-2, y FATZ-3 comparten del 34 al 40 por ciento de identidad de secuencia. Los científicos reconocieron fragmentos resistentes a la proteólisis, después de realizar experimentos de proteólisis. Cuando combinaron la cromatografía de exclusión por tamaño (SEC) con la dispersión de luz de múltiples ángulos, observaron los monómeros predominantes en condiciones experimentales. Luego caracterizaron aún más los monómeros usando SEC combinado con dispersión de rayos X de ángulo pequeño y también destacaron la naturaleza intrínsecamente desordenada / de estado de conjunto de los monómeros usando espectros de coherencia cuántica única (HSQC), para ambos constructos. Para comprender la estequiometría de unión de las proteínas FATZ-1-a-3 a la α-actinina-2, Sponga y col. utilizaron cromatografía de exclusión de tamaño-dispersión de luz multiangular (SEC-MALS). Para caracterizar la estequiometría de unión de las proteínas FATZ-1-a-3 a la α-actinina-2, Sponga y col. utilizó SEC-MALS. El resultado mostró cómo cada una de las tres proteínas FATZ formaba un complejo estrecho con α-actinina-2, con una estequiometría de unión de dos moléculas FATZ por dímero de α-actinina-2. Esa es una molécula de FATZ por subunidad de α-actinina-2. A continuación, el equipo utilizó calorimetría de titulación isotérmica (ITC) para cuantificar la afinidad de interacción.
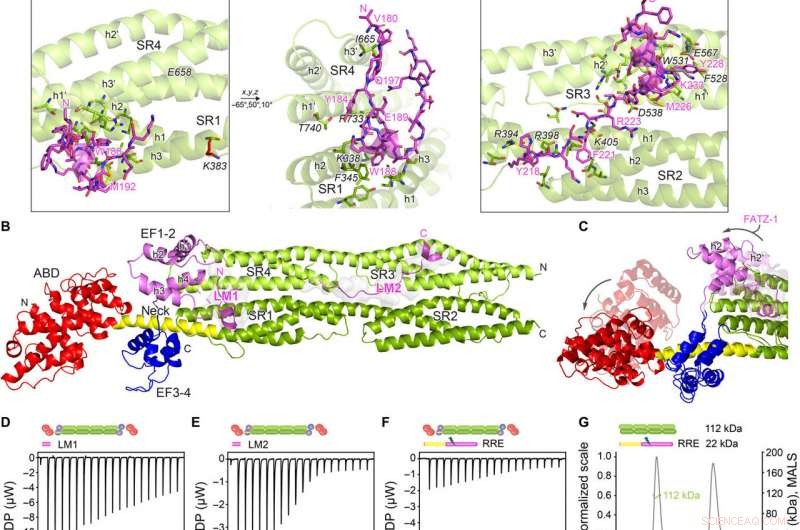
Las estructuras cristalinas de α-actinina-2 / FATZ-1 revelan dos motivos de unión lineales en FATZ-1. (A) Estructura cristalina de rod-α-actinin-2 / mini-FATZ-1 (en verde / magenta), junto con la secuencia de consenso FATZ-1 determinada (35 a 80% y 60 a 84% de identidad de secuencia por pares para LM1 y LM2, respectivamente). Los residuos reticulados se indican con azul, rojo, y estrellas / bolas / palos grises en la secuencia / estructura. Los Se-Mets identificados se muestran en amarillo. El dímero varilla-α-actinina-2 se ensambla a través de un doble eje cristalográfico entre parejas de simetría (círculo negro). Residuos que interactúan (varilla-α-actinina-2 en cursiva), junto con hélices de SR1 / SR2 (h1, h2, y h3) y SR3 / SR4 (h1 ′, h2 ′, y h3 ′), se muestran en vistas de cerca. (B) Estructura cristalina de hd-α-actinina-2 / Δ91-FATZ-1 (LM1 y LM2 como dibujos animados magenta y superficie gris transparente; hd-α-actinina-2 codificada por colores como en la Fig. 2A). (C) Comparación de [Protein Data Bank (PDB) código 4D1E] no unido y unido (este trabajo) hd-α-actinin-2. ABD y EF1-2 de hd-α-actinina-2 no unida se muestran con transparencia. Análisis ITC para la interacción del péptido LM1 con α-actinina-2 (D), Péptido LM2 con α-actinina-2 (E), y mutante RRE Δ91-FATZ-1 con α-actinina-2 (F). Análisis SEC-MALS para la interacción del mutante RRE Δ91-FATZ-1 con varilla-α-actinina-2 (G) y Δ91-FATZ-1 con varilla-α-actinina-2 (H) de E. histolytica. Crédito:Science Advances, doi:10.1126 / sciadv.abg7653
Múltiples sitios de unión para el complejo proteico.
El equipo observó cómo FATZ-1 interactuaba con la α-actinina-2 a través de múltiples sitios de unión. Para reducir los sitios de unión de FATZ-1, Sponga y col. utilizaron proteólisis limitada y reticulación química junto con espectrometría de masas en el complejo proteico. Para luego ayudar a la cristalización de este complejo proteico, Luego, el equipo también combinó la información de la matriz de péptidos y generó una construcción más corta conocida como mini-FATZ-1 para estudios adicionales sobre su biología estructural. Luego, los científicos validaron los modelos difusos desarrollados en el trabajo utilizando la viscosidad intrínseca calculada y derivada experimentalmente, un parámetro hidrodinámico de la conformación de proteínas. Para luego comprender la contribución de la α-actinina-2 para localizar las proteínas FATZ en el disco Z del sarcómero, Sponga y col. transfectaron proteínas FATZ-1 o FATZ-2 marcadas con GFP en mioblastos de ratón inmortalizados o cardiomiocitos de rata neonatal. Tanto las proteínas FATZ-1 como las -2 se dirigieron correctamente al disco Z y se co-localizaron con α-actinina-2.
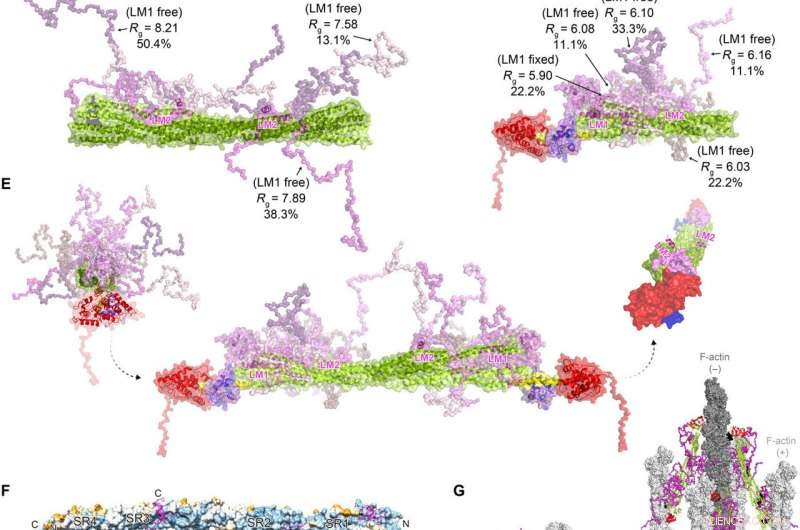
FATZ-1 forma un complejo difuso con α-actinina-2 que da como resultado una arquitectura polar del complejo. Datos experimentales SAXS de varilla-α-actinina-2 / Δ91-FATZ-1 (A) y hd-α-actinina-2 / Δ91-FATZ-1 (B), con el modelo correspondiente se ajusta a los datos de los conjuntos seleccionados. GAJOE, Algoritmo genético que juzga la optimización de conjuntos. Regiones flexibles de Δ91-FATZ-1, no visible en nuestras determinadas estructuras cristalinas, se generaron con EOM manteniendo LM1 fijo o libre (10, 000 modelos para cada uno). Representantes seleccionados del modelo de conjunto para rod-α-actinin-2 / Δ91-FATZ-1 (C) y hd-α-actinin-2 / Δ91-FATZ-1 (D), junto con sus fracciones de volumen y Rg dentro del conjunto. (E) Modelo integrativo de α-actinina-2 / Δ91-FATZ-1 difusa construido utilizando cristalografía de rayos X y modelos SAXS de hd-α-actinina-2 / Δ91-FATZ-1. Rotación de las hélices LM2 de moléculas FATZ-1 unidas entre sí, así como la torsión de la varilla a lo largo del eje longitudinal de α-actinina-2, se muestra en el recuadro derecho (las partes flexibles FATZ-1 se omiten para mayor claridad). (F) Superficie de la estructura de varilla-α-actinina-2 / FATZ-1 que muestra la conservación de la secuencia de residuos de interacción de α-actinina para FATZ-1 (alineación realizada utilizando 1505 α-actininas de vertebrados). (G) Modelo de F-actina / α-actinina-2 / FATZ-1 (F-actina en gris claro y oscuro) basado en una estructura de tomografía crioelectrónica del disco Z y el modelo integrativo. Crédito:Science Advances, doi:10.1126 / sciadv.abg7653
panorama
De este modo, Antonio Sponga y sus colegas describieron cómo el ensamblaje de sarcómero comenzó a partir de cuerpos Z de α-actinina-2, para incluir proteínas como FATZ, miotilina, y actina, para nombrar unos pocos. El resultado indica que las proteínas de la familia FATZ están disponibles en cuerpos Z y discos Z maduros con un papel en las vías de señalización de proteínas para unirse a la calcineurina. El equipo destacó el papel de FATZ-1, el miembro de la familia más estudiado y su interacción con la principal proteína del disco Z α-actinina-2. La estructura y el mecanismo de unión del complejo difuso α-actinina-2 / FATZ-1 apoyaron la función FATZ-1 como una proteína de andamiaje clásica en el ensamblaje del disco Z. Estudios posteriores revelarán si los mismos principios se aplican en condiciones fisiológicas en células vivas.
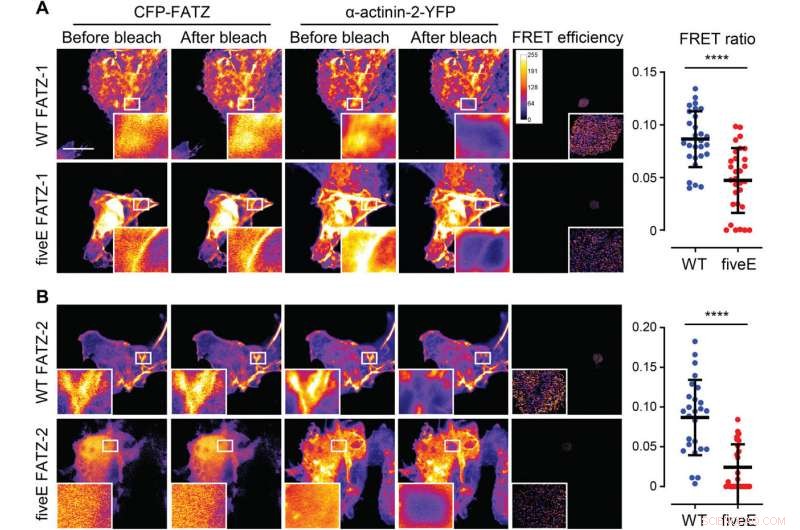
La α-actinina-2 estabiliza las proteínas FATZ en el disco Z. (A) Células COS-1 que coexpresan FATZ-1 (WT FATZ-1) marcada con CFP mejorada (ECFP) o el mutante fiveE correspondiente, en combinación con actinina-2-EYFP, según se determina en células fijadas mediante fotoblanqueo del aceptor. Se muestran imágenes representativas antes y después del blanqueo de ambas proteínas. Se muestran las regiones de interés blanqueadas (recuadros), junto con las eficiencias de FRET utilizadas para calcular las relaciones de FRET presentadas en el gráfico adyacente [n =28 (WT) y 30 (cincoE), **** P <0,0005, Prueba t de Student). (B) Las mismas células que en (A) pero coexpresando variantes de FATZ-2 etiquetadas con ECFP en combinación con EYFP-α-actinina-2 [n =26 (WT) y 25 (cincoE), **** P <0,0005, Prueba t de Student). Barras de escala, 10 μm en todas las imágenes. Crédito:Science Advances, doi:10.1126 / sciadv.abg7653
© 2021 Science X Network