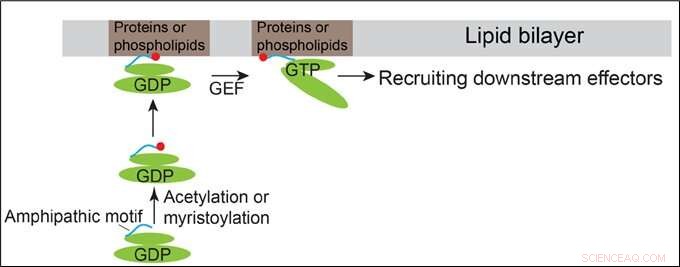
Modelo que demuestra cómo se reclutan Arfrp1 y Arl14 en las membranas. Crédito:HKUST
Las pequeñas GTPasas de la familia del factor de ribosilación ADP (Arf) son iniciadores clave de varios procesos fisiológicos, incluida la secreción, endocitosis, fagocitosis y transducción de señales. Las proteínas de la familia Arf funcionan para mediar en el reclutamiento de efectores citosólicos en compartimentos subcelulares específicos. Este proceso facilita a los efectores Arf realizar el reconocimiento de carga, modificación de lípidos u otras funciones celulares.
El bloqueo de las actividades de las proteínas de la familia Arf inhibe la secreción de moléculas importantes de la célula y también inhibe la absorción celular de nutrientes. Los defectos en Arfs o sus proteínas reguladoras están relacionados con diversas enfermedades hereditarias, incluida la discapacidad intelectual ligada al cromosoma X (XLID), Síndrome de Joubert, Síndrome de Bardet-Biedl y disfunción de los cilios. Por lo tanto, El estudio de los mecanismos moleculares de las actividades intracelulares reguladas por Arf representa una oportunidad para comprender la etiología de estas enfermedades y desarrollar nuevas estrategias terapéuticas.
Las proteínas de la familia Arf tienen un ciclo entre un estado inactivo unido a GDP y un estado activo unido a GTP. Tienen organizaciones estructurales similares que contienen un motivo de hélice anfipática N-terminal y los dominios de conmutación. Los dominios de cambio de las proteínas Arf se unen directamente a sus correspondientes factores de intercambio de nucleótidos de guanidina (GEF), permitiendo así que las proteínas Arf se unan a GTP. Generalmente se concibe que el reclutamiento de proteínas Arf en la membrana se inicia mediante cambios conformacionales de proteínas Arf inducidos por la unión a GTP.
Además de este mecanismo convencional, El profesor Guo y su equipo descubrieron que los motivos anfipáticos N-terminales de la proteína de la familia Arf localizada en Golgi, Arfrp1, y la proteína de la familia Arf localizada en endosoma y membrana plasmática, Arl14, son suficientes para determinar localizaciones subcelulares específicas de una manera independiente de GTP. El intercambio de los motivos de hélice anfipática entre estas dos proteínas Arf provoca el cambio de sus localizaciones. La determinación espacial mediada por la hélice Arfrp1 requiere su socio vinculante Sys1. Además, el estudio indica que la acetilación de la hélice Arfrp1 y la miristoilación de la hélice Arl14 son importantes para la localización subcelular específica. Un modelo propuesto representa el reclutamiento de membrana de Arfrp1 y Arl14.
Este estudio revela nuevos conocimientos sobre la maquinaria molecular que regula la asociación de membranas de algunas proteínas Arf, sugiriendo que la asociación de la membrana y la activación de algunas proteínas Arf están desacopladas. Este estudio también ofrece nuevos motivos cortos para dirigir proteínas a localizaciones intracelulares específicas.
Los hallazgos fueron publicados recientemente en la revista científica The Revista de química biológica .