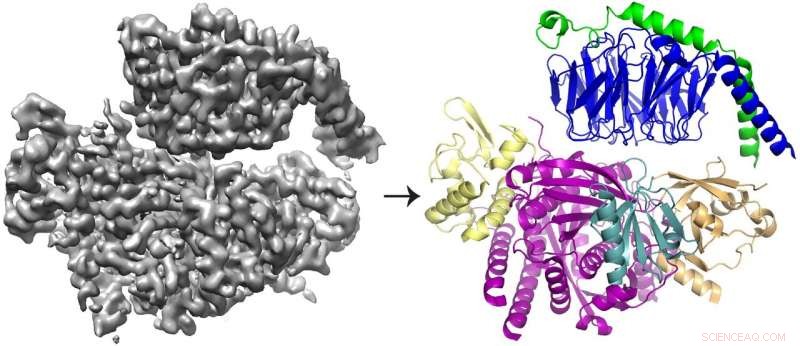
La reconstrucción crio-EM 3D (izquierda) de la proteína P-Rex1 unida a Gβγ y el modelo de proteína (derecha) que muestra que Gβγ (arriba; azul y verde) se une a un compacto, superficie multidominio en P-Rex1 (abajo; amarillo, magenta, verde azulado y dorado). Crédito:Jennifer Cash, Instituto de Ciencias de la Vida de la U-M.
Cuando las células de nuestro cuerpo necesitan moverse, para atacar una infección o curar una herida, por ejemplo, las proteínas celulares envían y reciben una cascada de señales que dirigen a las células al lugar correcto en el momento correcto. Es un proceso que las células cancerosas pueden secuestrar para diseminarse a nuevos tejidos y órganos.
Ahora, un equipo de investigadores dirigido por el Instituto de Ciencias de la Vida de la Universidad de Michigan ha arrojado luz sobre un impulsor clave de este proceso. Los resultados, programado para publicar el 16 de octubre en Avances de la ciencia , ofrecen información importante sobre la migración celular no solo en condiciones normales de salud, pero también en el pecho, próstata y otros tipos de cáncer.
Los investigadores probaron específicamente una proteína llamada P-Rex1 (fosfatidilinositol 3, 4, Intercambiador de Rac dependiente de 5-trifosfato 1), que se activa cuando se une a otra proteína, Gbg. A pesar del descubrimiento de P-Rex1 hace más de 15 años, Precisamente cómo interactúan las dos proteínas y cómo esta interacción conduce al movimiento celular sigue siendo poco conocido.
Utilizando una combinación de técnicas de biología estructural y bioquímica, los investigadores han revelado la estructura de P-Rex1 unido a Gbg, proporcionando una instantánea de cómo se desarrolla este intrincado proceso de activación.
"Conocer la estructura de este complejo proteico proporciona detalles mecanicistas que nos permiten comprender cómo se regula, "dijo Jennifer Cash, Investigador de LSI y autor principal del estudio. "Y cuando entendemos cómo se regula, podemos empezar a pensar en cómo modificar esa regulación e inhibir la señalización de P-Rex1 en los cánceres ".
El equipo descubrió que Gbg se une a una superficie extensa en P-Rex1 compuesta por varios dominios de proteínas diferentes. Estudios anteriores ofrecían argumentos contradictorios sobre qué dominio (o dominios) vinculaban a Gbg. Pero este último estudio pudo resolver el conflicto al tener una visión más amplia de la proteína, utilizando tecnologías más nuevas.
"Queríamos ver la enzima como un todo, y para hacer eso, realmente necesitábamos pasar a Cryo-EM, "dijo John Tesmer, profesor de ciencias biológicas en la Universidad de Purdue y uno de los autores principales del estudio.
Cryo-EM, o microscopía crioelectrónica, permite a los investigadores estudiar proteínas que no pueden visualizarse utilizando otras técnicas de biología estructural, como el complejo, estructura entretejida de P-Rex1. El proceso implica congelar proteínas en una fina capa de agua y luego usar electrones para capturar imágenes de su forma. Luego, se promedian cientos de miles de imágenes para crear una estructura 3-D.
Más allá de aclarar cómo Gbg se une y activa a P-Rex1, Estos nuevos hallazgos son una piedra de toque importante en el desarrollo de cryo-EM, dijo Michael Cianfrocco, Profesor asistente de LSI y autor principal del estudio.
La mayoría de las estructuras determinadas con crio-EM son más grandes, moléculas simétricas. Los resultados para P-Rex1, a diferencia de, representan una estructura de alta resolución de la proteína asimétrica más pequeña lograda a través de crio-EM hasta la fecha. Es más, un dominio grande en P-Rex1 tiene una estructura o pliegue que no se había identificado previamente en ninguna otra proteína de mamífero, requiriendo que el equipo lo construya pieza por pieza, una tarea difícil con datos crio-EM.
"Cryo-EM es todavía un campo relativamente nuevo, y la gente está realmente interesada en saber hasta dónde se pueden traspasar sus límites, "dijo Cianfrocco, quien también es profesor asistente de química biológica en la Facultad de Medicina de la U-M.
Los artículos de Science Advances se titulan "Estructura y análisis de microscopía crioelectrónica del andamio de señalización P-Rex1-Gbg".