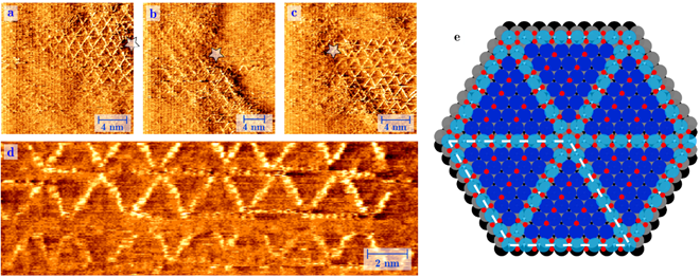
Izquierda:Imagen obtenida con un microscopio de túnel de barrido (STM). Imagen de una superficie de platino bajo una presión de 1 atmósfera de oxígeno a 256 ° C. Bajo estas circunstancias, vemos el crecimiento espontáneo de una estructura de rueda de radios de filas de PtO2 incrustadas con muchos errores estructurales. Derecha:Los átomos de platino oxidados en azul claro, los átomos de oxígeno en rojo y los átomos regulares de platino en la superficie en azul oscuro (capa 1), gris (capa 2) y negro (capa 3). Crédito:Universidad de Leiden
Los automóviles están equipados con catalizadores para desarmar los gases de escape tóxicos. El platino juega un papel importante allí. Los físicos y químicos de Leiden ahora han visto por primera vez el mecanismo detrás de un catalizador de platino. Con una comprensión fundamental del proceso, los científicos pueden usar este material raro de manera más eficiente. Publicación en Comunicaciones de la naturaleza .
Los gases de escape de más de mil millones de automóviles en todo el mundo contribuyen significativamente al calentamiento global. Pero sin catalizadores, los coches serían aún más contaminantes. Después de que los gases de escape tóxicos abandonen el motor, los catalizadores los convierten en sustancias menos dañinas. El platino juega un papel importante aquí, eliminando el monóxido de carbono tóxico. Este metal noble es muy raro y, por lo tanto, los científicos están investigando cómo usarlo de la manera más eficiente posible.
Platino
El platino actúa como catalizador al recolectar átomos de oxígeno (O), y dejar que se unan al tóxico monóxido de carbono (CO), para crear el dióxido de carbono (CO2) menos dañino. El físico Joost Frenken y los químicos Irene Groot y Matthijs van Spronsen de la Universidad de Leiden ahora han imaginado por primera vez cómo funciona este proceso a nivel atómico. Con un microscopio especial de fabricación casera, vieron crecer una capa de oxígeno ultrafina sobre una superficie de platino. Esto sucedió en circunstancias realistas, es decir, a la misma alta presión y temperatura que el interior de un motor, lo que hizo que el experimento fuera más difícil. Los investigadores descubrieron que los átomos de oxígeno están algo "sueltos, "para que puedan reaccionar fácilmente con otras sustancias. Esto proporciona por primera vez una buena explicación de la alta actividad catalítica del platino en las reacciones de oxidación.
Eficiencia
Al desentrañar el mecanismo detrás del catalizador de platino, los científicos de Leiden contribuyen a una mejor comprensión fundamental de la catálisis. A la larga, los científicos podrían aprovechar este conocimiento para utilizar materiales raros como el platino de manera más eficiente. Groot:"Entonces, o necesitamos menos platino para obtener el mismo resultado, o entendemos tan bien el mecanismo de catálisis detrás del platino que podemos crear un material sustituto ".