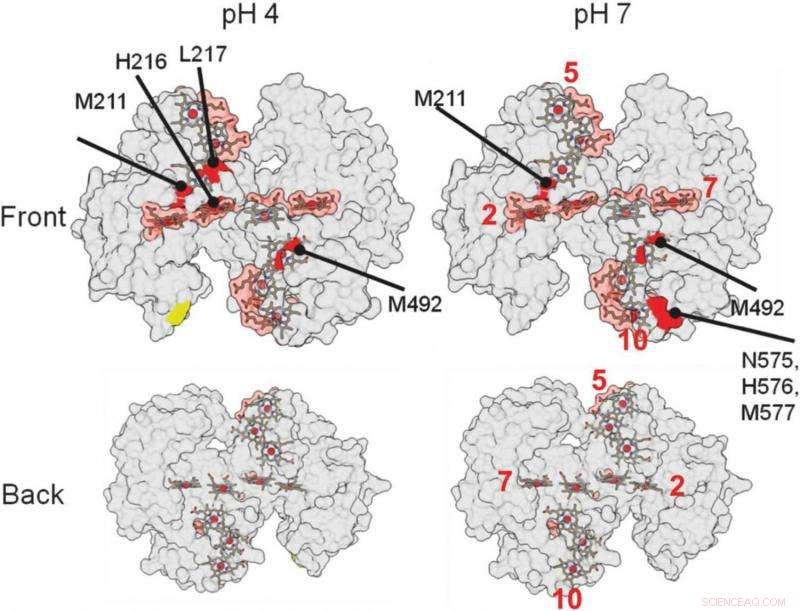
en estas representaciones estructurales tridimensionales de la proteína, ayudó a los investigadores a identificar dónde se une la proteína con un mineral. Las áreas rojas indican posibles áreas de encuadernación. Crédito:Berkeley Lab
Los científicos han descubierto los detalles de un acoplamiento no convencional entre una proteína bacteriana y un mineral que permite que la bacteria respire cuando no hay oxígeno disponible.
La investigación, realizado por un equipo de científicos del Laboratorio Nacional Lawrence Berkeley del Departamento de Energía (Berkeley Lab), podría conducir a nuevas innovaciones en la vinculación de proteínas con otros materiales para dispositivos electrónicos de base biológica, como sensores que pueden diagnosticar enfermedades o detectar contaminantes. También podría ayudar a los investigadores a comprender y controlar las reacciones químicas provocadas por estas interacciones proteína-material.
"Mover electrones a metales puede hacer que diferentes minerales crezcan o se disuelvan. Estudiar cómo una proteína hace esto puede ayudarnos a comprender cómo los organismos remodelan su entorno y producen biominerales para los dientes o la protección. "dijo Caroline Ajo-Franklin, un científico de planta en la Instalación de Nanoestructuras Biológicas en la Fundición Molecular de Berkeley Lab, que es un centro de investigación en nanociencia.
Ajo-Franklin dirigió el estudio, publicado en línea en el Revista de la Sociedad Química Estadounidense a principios de este mes.
"Comprender cómo se ven estas interacciones entre proteínas y materiales puede ayudarnos a diseñarlos mejor, " ella añadió, "y darnos una idea de cómo conectar células vivas con dispositivos".
Los investigadores se basaron en una técnica basada en rayos X en la fuente de luz avanzada (ALS) de Berkeley Lab, conocido como "huella, "para identificar las conexiones químicas entre la proteína bacteriana y las nanopartículas compuestas de hierro y oxígeno.
El estudio, que identificó un sitio de unión sorprendentemente pequeño y débil, también se benefició de las herramientas y la experiencia de la Fundición Molecular del Laboratorio; y el Instituto Conjunto de BioEnergía dirigido por el laboratorio, que se especializa en la investigación de biocombustibles.
La estructura de esta proteína exótica había sido previamente mapeada de forma aislada con detalles a escala atómica por otros grupos de investigación utilizando cristalografía de rayos X, que requirió una forma cristalizada de la proteína. Pero los científicos no sabían cómo se unía al mineral que contiene metal; las técnicas convencionales no pueden ver este proceso de unión.

Sayan Gupta, un experto en huellas de rayos X, muestra un tipo de portamuestras que se utilizó para estudiar cómo se une una proteína a un mineral. Crédito:Paul Mueller
En 2014, Ajo-Franklin aprendió de Corie Ralston, otro investigador de laboratorio que trabaja en la División de Biofísica Molecular y Bioimagen Integrada (MBIB), sobre la técnica de huella de espectrometría de masas de rayos X, una forma innovadora de sondear con precisión las proteínas y su entorno con rayos X en el ALS.
Ajo-Franklin y Ralston estaban llevando a cabo proyectos separados de Investigación y Desarrollo Dirigidos por Laboratorio, y vieron que los dos esfuerzos podían ser complementarios.
Ralston había adoptado la técnica de huellas de rayos X de su antiguo asesor, Mark Chance, un profesor de la Universidad Case Western Reserve que estableció la técnica de huellas de rayos X en el Laboratorio Nacional Brookhaven en Long Island, N.Y. Esta técnica de rayos X solo está disponible en ALS y en la Fuente de luz sincrotrón nacional II de Brookhaven (NSLS-II).
"La huella puede decirle cómo interactúan las proteínas, ", Dijo Ralston." Puede proporcionar información estructural y dinámica sobre las proteínas cerca de su entorno nativo ".
La proteína seleccionada para el estudio es de una bacteria reductora de metales, Shewanella oneidensis, que "come azúcar y básicamente respira minerales" cuando no hay oxígeno disponible, Señaló Ajo-Franklin. "Una de las razones por las que estos organismos son tan divertidos de estudiar es que interactúan con una amplia gama de materiales".
Después de Tatsuya Fukushima, un ex científico del laboratorio que fue coautor principal del estudio, encontró una forma adecuada de preparar la proteína y las nanopartículas en una solución líquida para estudios de rayos X, Sayan Gupta, un experto en huellas de rayos X en la División MBIB de Berkeley Lab, usó una línea de rayos X en el ALS para estudiar las muestras.
"Estamos capturando instantáneas del estado de esta molécula en un momento determinado, "Dijo Gupta." Es una técnica simple y te da mucha información sobre el estado nativo de una proteína ".
En esta técnica, Los rayos X producen moléculas altamente reactivas conocidas como radicales hidroxilo cuando pasan a través de la solución líquida que rodea la proteína. Estos radicales modifican la proteína de una manera que permite a los científicos identificar ligeras variaciones químicas donde la proteína está en contacto con la solución.
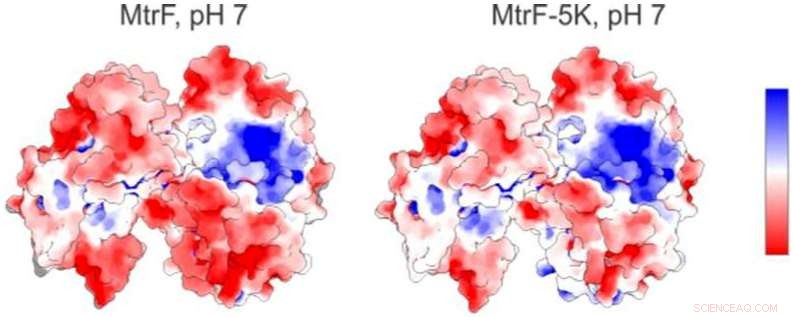
Un mapa electrostático (izquierda) de una proteína estudiada en la fuente de luz avanzada de Berkeley Lab muestra regiones cargadas positivamente (azul) y cargadas negativamente (rojo). A la derecha hay un mapa electrostático predicho para una forma mutante de la proteína. Crédito:Berkeley Lab
Las regiones de la proteína que interactúan con otras proteínas o materiales están protegidas de los radicales y no están sujetas a las alteraciones químicas. Los lugares donde la proteína no se altera indican dónde se produce la unión.
En el último estudio, Estas instantáneas químicas producidas por la técnica de huella de rayos X en diferentes momentos fueron posteriormente analizadas mediante una técnica conocida como espectrometría de masas en el Joint BioEnergy Institute.
Un análisis detallado de Fukushima reveló cómo la proteína se conectaba al mineral.
"El mayor hallazgo, eso fue bastante sorprendente, fue que nuestras proteínas se unen relativamente débilmente, ", Dijo Ajo-Franklin." La mayoría de las proteínas que interactúan con los materiales se unen muy fuertemente, "cambiando de forma a medida que forman esta conexión. Esta proteína en particular no parece cambiar de forma en absoluto y solo interactúa con el mineral en un área pequeña, requiriendo aproximadamente cinco veces menos energía de enlace, en comparación, que las proteínas típicas que forman biominerales.
De hecho, eso tiene mucho sentido, ella añadió. "El trabajo de esta proteína es transferir electrones al mineral, por lo que no tiene que estar en contacto por mucho tiempo ".
El equipo de investigación ahora está trabajando para estudiar cómo esta y otras proteínas similares interactúan con una variedad de minerales.
"Hay un montón de proteínas en esta familia, ", Dijo Ajo-Franklin." Estamos muy emocionados de ver cómo estas proteínas interactúan con diferentes materiales. ¿Utilizan todos la misma estrategia vinculante? "
Este estudio ya proporciona ideas sobre cómo rediseñar estas proteínas para hacer mejores conexiones electrónicas y, por lo tanto, sensores bioelectrónicos más sensibles, un proyecto en el que está trabajando Ajo-Franklin.