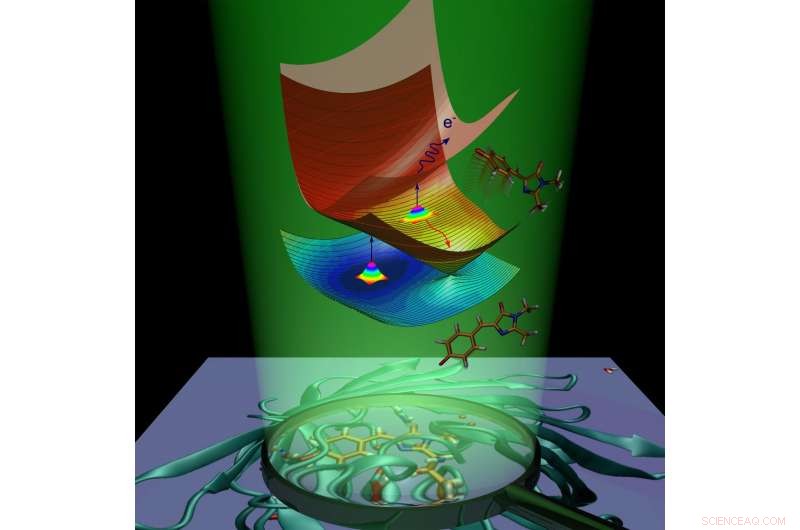
Dinámica molecular del cromóforo de la proteína verde fluorescente causada por la absorción de luz. Crédito:Anastasia Bochenkova
Investigadores de la Universidad Estatal Lomonosov de Moscú, en cooperación con físicos moleculares daneses, han revelado el mecanismo que determina la sensibilidad de la proteína verde fluorescente a la exposición a la luz. Los científicos han demostrado que un grupo cromóforo aislado es capaz de emitir luz fuera del entorno proteico. mientras que la función de la proteína es mejorar sus propiedades fluorescentes. Los resultados se publican en el Revista de la Sociedad Química Estadounidense .
Las proteínas de la familia GFP se utilizan ampliamente como biomarcadores. Con su ayuda los investigadores pudieron visualizar los procesos biológicos que tienen lugar dentro de las células vivas. Estas proteínas se utilizan ampliamente en biología molecular y celular debido a su capacidad única de emitir fluorescencia tras la absorción de luz de una determinada longitud de onda.
Grupos cromóforos, o cromóforos, son responsables de la absorción de la luz. El cromóforo está compuesto por solo tres residuos de aminoácidos. Hasta ahora, Los investigadores creían que el entorno de las proteínas hacía que su cromóforo emitiera luz bajo irradiación. Esta idea fue apoyada por el hecho de que el cromóforo aislado pierde sus propiedades fluorescentes con la desnaturalización de la proteína. es decir, desdoblamiento de la proteína. Por primera vez, los autores han predicho y probado experimentalmente que el cromóforo aislado también puede emitir fluorescencia fuera del entorno proteico, pero solo a determinadas temperaturas.
Tras la absorción de luz, la proteína fluorescente gana energía extra y pasa al estado de excitación electrónica. La molécula de proteína se esfuerza por volver al estado fundamental al deshacerse del exceso de energía. Este proceso se denomina desactivación y procede de dos formas. El primero es la fluorescencia. En tránsito del estado excitado al estado fundamental, el cromóforo emite energía en forma de luz, y como un resultado, la proteína se vuelve luminosa.
La segunda forma se llama relajación no radiativa. Durante este proceso, energía de excitación electrónica, transferido a una molécula por absorción de luz, se transforma en energía vibracional de núcleos. La conversión interna dentro de la proteína verde fluorescente es seguida por una reacción química:isomerización cis-trans del cromóforo (es decir, rotación intramolecular alrededor de uno de los dobles enlaces dentro de la molécula).
En el caso del cromóforo aniónico (cargado negativamente) de la proteína verde fluorescente, la energía también se puede transferir a un electrón, que sale del cromóforo. El cromóforo que sufre isomerización o pierde un electrón, elimina el exceso de energía electrónica y no emite fluorescencia. La fluorescencia se denomina canal radiativo de desactivación, mientras que la conversión interna y la emisión de electrones se denominan canales no radiativos. Los científicos han utilizado experimentalmente ambos canales no radiativos para estudiar la desintegración del estado excitado y la recuperación del estado fundamental del cromóforo de GFP aislado a diversas temperaturas.
Los científicos han demostrado que el cromóforo de GFP aislado puede quedar atrapado en el estado excitado debido a la presencia de barreras de energía intrínsecas a lo largo de las vías de desactivación no radiativa. Cuando el cromóforo se enfría a 100 K, la captura dura nanosegundos, habilitando así el canal radiativo lento. Las barreras de atrapamiento evitan que el cromóforo regrese al estado fundamental mediante una conversión rápida no radiativa y que provoque la fluorescencia de la molécula.
La química Anastasia Bochenkova de la Universidad Estatal Lomonosov de Moscú dice:"El cromóforo GFP es intrínsecamente fluorescente. Las interacciones entre el grupo cromóforo y el entorno proteico más cercano mejoran las condiciones para atrapar el cromóforo en el estado excitado, mejorando así la fluorescencia molecular. Como resultado, el canal radiativo se vuelve predominante dentro de la proteína ya a temperatura ambiente ".
Los científicos han estudiado las propiedades de los cromóforos tanto teórica como experimentalmente. Los científicos elaboraron un modelo teórico y estimaron una vida útil en estado excitado del cromóforo aislado, basado en los cálculos de química cuántica de alto nivel. Tales cálculos requieren recursos informáticos de alto rendimiento, y los científicos utilizaron el Centro de Supercomputación Lomonosov para sus estudios.
Los científicos daneses diseñaron y crearon una nueva técnica experimental para estudiar la dinámica molecular inducida por la luz de cromóforos cargados aislados en vacío:espectroscopía de acción de bomba-sonda de femtosegundos con resolución temporal 2-D. Se variaron tanto el tiempo de retardo entre dos pulsos de láser de femtosegundos como el tiempo de desintegración de una acción molecular particular. La nueva técnica resuelve la dinámica inducida por la luz del cromóforo GFP a medida que ocurre en diferentes canales de desintegración a través de los estados electrónicos excitados y terrestres. dependiendo de la temperatura. Según los resultados, Los investigadores han concluido que los cromóforos nativos de GFP son intrínsecamente capaces de emitir fluorescencia fuera del entorno proteico con una vida útil de nanosegundos. apoyando plenamente las predicciones teóricas.
Anastasia Bochenkova dice:"Nuestra investigación tiene como objetivo revelar los mecanismos moleculares de funcionamiento de los sistemas vivos. Un desafío fundamental es comprender la relación entre las propiedades de todo un biosistema sensible a la luz y su cromóforo activo mucho más pequeño, que está en el corazón de la maquinaria molecular. Aquí, Hemos demostrado que las propiedades de un solo cromóforo son importantes para comprender los mecanismos de acción de toda la proteína GFP. Este conocimiento está en la intersección de la física, química y biología, y da como resultado la revisión del paradigma predominante sobre el papel del entorno proteico en la fluorescencia de la proteína GFP. Más allá de resolver la pregunta sobre el origen de la fluorescencia intrínseca de GFP, el trabajo muestra que el conocimiento molecular detallado obtenido a través de cálculos de química cuántica de alto nivel puede usarse junto con la ingeniería molecular en el diseño de nuevos biomateriales funcionales con una fotorrespuesta óptima ".