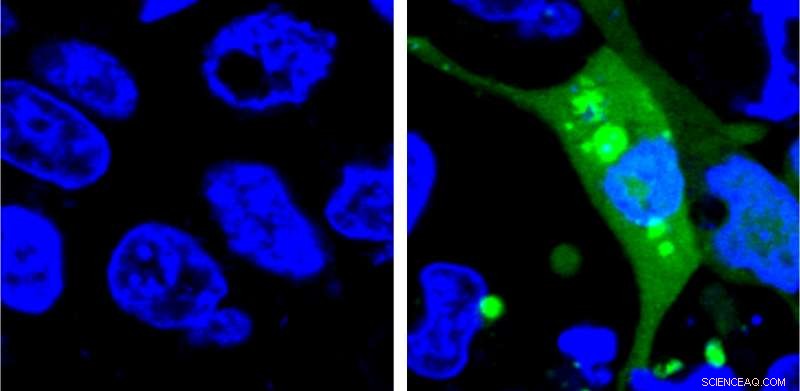
Imagen de células que expresan el sensor AgHalo antes (izquierda) y después (derecha) del estrés celular. El sensor AgHalo se enciende cuando las proteínas mal plegadas comienzan a agregarse y proporciona una medida cuantitativa del estrés celular que se puede utilizar para evaluar la seguridad de los medicamentos. Crédito:Yu Liu, Universidad Penn State
Una nueva técnica para evaluar la seguridad de los medicamentos puede detectar el estrés en las células en etapas más tempranas que los métodos convencionales. que se basan principalmente en la detección de la muerte celular. El nuevo método utiliza un sensor fluorescente que se enciende en una célula cuando las proteínas mal plegadas comienzan a agregarse, una señal temprana de estrés celular. El método se puede adaptar para detectar agregados de proteínas causados por otras toxinas, así como enfermedades como el Alzheimer o el Parkinson. Un artículo que describe el nuevo método, por un equipo de investigadores de la Penn State University, aparece en la revista Edición internacional Angewandte Chemie .
"El estrés proteico inducido por fármacos en las células es un factor clave para determinar la seguridad de los fármacos, "dijo Xin Zhang, profesor asistente de química y de bioquímica y biología molecular en Penn State, el autor principal del artículo. "Los medicamentos pueden hacer que las proteínas, que son largas cadenas de aminoácidos que deben doblarse con precisión para funcionar correctamente, se doblen mal y se agrupen en agregados que eventualmente pueden matar la célula. Nos propusimos desarrollar un sistema que pueda detectar estos agregados en etapas muy tempranas y que también utiliza tecnología que es asequible y accesible para muchos laboratorios ".
El nuevo sistema es el primero en utilizar un sensor fluorescente que no se enciende hasta que las proteínas mal plegadas comienzan a agregarse. Los investigadores diseñaron una proteína inestable, llamada AgHalo, que está etiquetada con un tinte fluorescente especial que se activa en una sustancia hidrófoba, es decir, repelente al agua, medio ambiente. Las porciones hidrófobas de las proteínas suelen estar enterradas profundamente en la estructura de una proteína correctamente plegada porque el entorno de la célula es principalmente agua. Cuando la proteína AgHalo comienza a doblarse mal y agregarse, el tinte puede interactuar con las porciones hidrofóbicas de la proteína y comenzar a emitir fluorescencia.
Los sistemas anteriores usaban sensores que siempre estaban encendidos. Las células tendrían una fluorescencia difusa general antes de cualquier estrés y los sistemas solo podrían detectar el estrés de las proteínas cuando las proteínas mal plegadas se agregan. formando puntos más brillantes de fluorescencia que eran lo suficientemente grandes como para ser vistos bajo un microscopio.
"Una ventaja adicional de nuestro sistema es que el nivel de fluorescencia se correlaciona con la cantidad de agregación de proteínas en la célula, para que podamos cuantificar el nivel de estrés ", dijo Yu Liu, investigador postdoctoral en Penn State y primer autor del artículo. "También, porque nuestro método mide el nivel de fluorescencia, en lugar de tener que identificar la fluorescencia bajo un microscopio, se puede hacer utilizando tecnología más accesible, como lectores de placas, y es mucho más de alto rendimiento ".
Los investigadores usaron su sensor para probar el nivel de estrés proteico causado por cinco medicamentos contra el cáncer de uso común. Aunque ninguno de los medicamentos que prueban causa una muerte celular significativa en pruebas de seguridad de medicamentos anteriores, los cinco produjeron algún nivel de estrés proteico detectable por el sensor AgHalo.
"Debido a que probamos los medicamentos contra el cáncer en dosis mucho más altas que las que se usan normalmente para el tratamiento, Nuestros resultados no necesariamente cuestionan el uso continuado de estos medicamentos, "dijo Liu." Sin embargo, porque el estrés proteico de los tratamientos a largo plazo podría tener efectos duraderos, evaluar medicamentos con nuestro nuevo sensor ayudará en el desarrollo de medicamentos más seguros ".
El estrés por proteínas puede ser inducido por otros muchos factores. Calor, toxinas, infecciones bacterianas, cáncer, e incluso el envejecimiento puede hacer que las proteínas se doblen mal y formen agregados en las células. "Con nuestro método, Podemos detectar cuantitativamente el estrés proteico en las células en etapas mucho más tempranas y, por lo tanto, los investigadores pueden comenzar a estudiar los mecanismos que utilizan las células para combatir este estrés y desarrollar compuestos que pueden mejorar la capacidad de la célula para manejar el estrés proteico. "dijo Zhang.