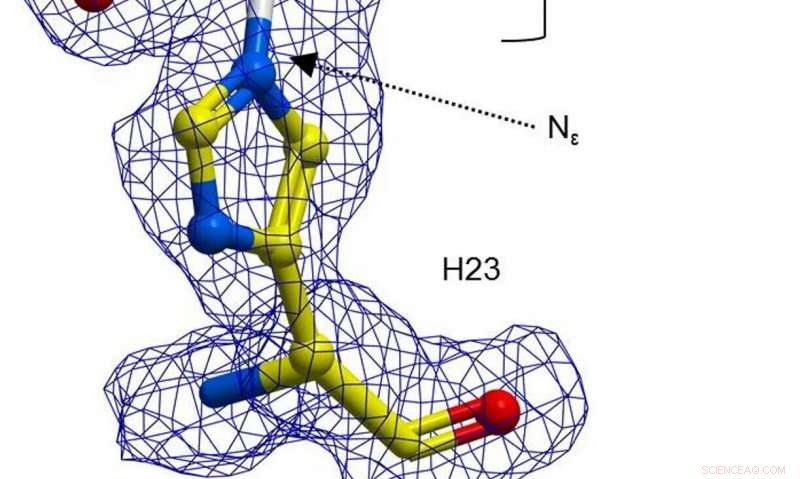
Una representación de bola y palo de H23 de BH32 inhibida con 2-bromoacetofenona, coloreado por tipo de átomo con átomos de carbono H23 en amarillo y carbonos de acetofenona en blanco. Densidad de electrones FEM clara (azul, contorneada en 1σ) se extiende entre el Nε del H23 y la acetofenona. Crédito: Naturaleza (2019). DOI:10.1038 / s41586-019-1262-8
Un equipo de químicos de la Universidad de Manchester ha encontrado una manera de incorporar un residuo anormal en una enzima para mostrar cómo se puede ampliar la gama catalítica de enzimas. En su artículo publicado en la revista Naturaleza , el grupo describe la expansión de la gama de enzimas catalíticas que podrían usarse para proporcionar una variedad más amplia de cadenas laterales para la catálisis, mediante el uso de un "alfabeto" extendido de aminoácidos. Adam Nelson, con la Universidad de Leeds, ha publicado un artículo de News and Views Research en el que se analiza el trabajo del equipo en el mismo número de la revista.
Como señala Nelson, No hay muchos residuos de aminoácidos naturales que las enzimas puedan usar para catalizar reacciones; señala que solo hay 20 tipos que pueden usarse para construir tales enzimas. Esta escasez de opciones ha llevado a los investigadores a considerar si la gama de aminoácidos que podrían ser utilizados por las enzimas para permitir más reacciones catalíticas podría ampliarse, tal vez mediante el uso de lo que los investigadores describen como un "alfabeto" de aminoácidos que proporcionan una mayor amplitud. variedad de cadenas laterales que se pueden utilizar para catálisis. En este nuevo esfuerzo, los investigadores emplearon un alfabeto de aminoácidos tan extendido para ampliar la gama de posibilidades. Informan que al hacerlo, pudieron construir una enzima usando miembros de un grupo catalítico no natural y demostraron que hacerlo podría conducir a mejoras usando un enfoque llamado evolución dirigida.
En su trabajo, los investigadores optaron por remodelar una enzima para convertirla en un catalizador más eficaz; empezaron señalando que un residuo de aminoácido de histidina en la enzima BH32 puede formar un compuesto intermedio de acil-enzima. Ese intermedio se hidrolizó para crear un producto de la reacción, pero el resultado no fue el esperado. A continuación, el equipo utilizó la evolución dirigida para optimizar el papel de la Nδ-metilhistidina. Eso implicó una serie de enfoques para forzar mutaciones. Como resultado, el equipo descubrió una variante llamada OE1.3, qué pruebas mostraron que era más eficiente. El equipo continuó con una evolución más dirigida y finalmente llegó a OE1.4, una enzima que demostró una actividad catalítica mejorada.
© 2019 Science X Network