Crédito:Wiley
Las bacterias resistentes a los antibióticos son una amenaza para la salud cada vez mayor, haciendo que los nuevos antibióticos sean esenciales. Investigadores alemanes han logrado recientemente un gran avance:descubrieron lugdunin en la nariz humana, un nuevo tipo de péptido cíclico que proviene de la bacteria Staphylococcus lugdunensis y tiene fuertes propiedades antimicrobianas contra Stahphylococcus aureus. entre otros. Los investigadores han podido aclarar el modo de acción sintetizando variantes. Como explican en el diario Angewandte Chemie , Está involucrado el transporte de protones a través de las membranas bacterianas.
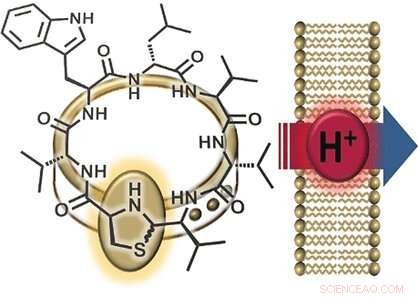
Una parte interesante de la estructura de lugdunin es su grupo tiazolidina (un anillo hecho de un nitrógeno, un azufre, y tres átomos de carbono), que forma parte de su anillo peptídico. Este anillo de cinco miembros se asemeja a un broche que "adorna" el anillo peptídico. Por esta razón, los investigadores llamaron a su nueva clase de materiales "fibupéptidos, "del latín fíbula , sentido corchete . Habiendo logrado previamente sintetizar lugdunin, el equipo de la Universidad de Tübingen y la Universidad de Göttingen (Alemania) optimizó la vía sintética para producir muchos derivados diferentes de esta sustancia natural. Esto permitió un estudio exhaustivo del mecanismo por el que funciona lugdunin. Los investigadores crearon una serie de derivados en los que reemplazaron cada uno de los aminoácidos en el anillo peptídico con alanina, uno en el que dejaron el "broche de adorno, "y un fibupéptido con una estructura que es la imagen especular de la lugdunina. Luego utilizaron estos derivados para realizar pruebas de actividad.
El equipo, compuesto por químicos, bioquímicos, y microbiólogos, descubrió que la estructura cíclica del péptido, el cierre de tiazolidina ", "y dos aminoácidos (triptófano y leucina), son fundamentales para la actividad antibiótica del compuesto. Además, el anillo peptídico siempre debe estar formado por D- y L-aminoácidos alternos. Sin embargo, no hubo diferencia en la actividad de la molécula original o su imagen especular. "Esto indica una falta de interacción receptor-ligando estereoespecífico, "afirma Nadine Schilling, un miembro del equipo encabezado por Stephanie Grond, "en lugar de, habla de la interacción con una pequeña molécula o ión ".
Otra observación fue que los derivados activos de la lugdunina descomponen el potencial eléctrico (la diferencia de voltaje entre el interior y el exterior) de las membranas celulares bacterianas. matando así las bacterias. La incorporación de una molécula de triptófano adicional intensificó la interacción con la membrana y fortaleció el efecto antibacteriano. Dice Grond:"Estos resultados sugieren el transporte de iones a través de la membrana bacteriana". Para examinar más de cerca esta característica, los investigadores produjeron vesículas sintéticas con un gradiente de pH en relación con la solución circundante. La adición de fibupéptidos activos condujo a una rápida ecualización del pH, sin destrucción de la membrana ni formación de poros. "El mecanismo consiste claramente en la translocación de protones a través de la membrana, ", dice Grond." Aún tenemos que determinar si el lugdunin actúa como un transportador móvil o un canal de protones ".