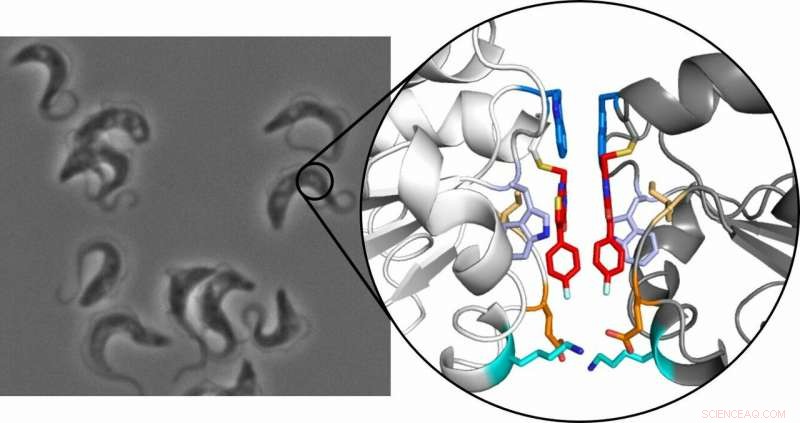
Tripanosomas, que causan la enfermedad del sueño africana, bajo el microscopio (izquierda) y la estructura cristalina del dímero de tripredoxina (derecha):Las dos moléculas inhibidoras están resaltadas en rojo. Crédito:Ute Hellmich, Annika Wagner
Los científicos que trabajan en una variedad de disciplinas unieron sus fuerzas para identificar un nuevo enfoque para combatir la enfermedad del sueño africana. La investigación fundamental realizada bajo la supervisión de la profesora Ute Hellmich de la Universidad Johannes Gutenberg de Mainz (JGU) ha revelado una estrategia prometedora para desarrollar un agente adecuado. "Todavía queda un largo camino por recorrer antes de llegar a un producto farmacéutico, ", dijo Hellmich." Pero nuestro trabajo altamente interdisciplinario que involucra parasitología, química teórica y orgánica, biología estructural, y la bioquímica ha demostrado cómo el parásito que causa la enfermedad del sueño puede volverse inofensivo ". Los investigadores lograron demostrar cómo una sustancia inhibidora específica se acopla y desactiva una proteína vital del parásito.
La enfermedad del sueño africana es causada por tripanosomas, protozoos unicelulares transmitidos por la picadura de una mosca tsetsé infectada. Según la Organización Mundial de la Salud, el número de personas infectadas ha disminuido en los últimos años, hasta un estimado de 15, 000 en 2014. Sin embargo, es difícil establecer la incidencia real de la enfermedad, ya que los primeros síntomas son similares a los de la malaria. "No solo las personas más pobres del África subsahariana están amenazadas, sino también su ganado, que se ven afectados en una escala dramática por ciertas especies de Trypanosoma brucei, "explicó la profesora bioquímica Ute Hellmich.
En la actualidad, solo un puñado de medicamentos para tratar la enfermedad del sueño, que es fatal si no se trata, están disponibles y estos tratamientos a menudo van acompañados de efectos secundarios graves e incluso muertes en hasta el 10 por ciento de los pacientes. Aunque actualmente se están desarrollando nuevos medicamentos, el enfoque del grupo de Hellmich va un paso más allá:"Nuestro inhibidor abre la perspectiva futura de poder diseñar inhibidores en un nivel fundamental y, por lo tanto, posiblemente también podría usarse en el tratamiento de infecciones con otros, parásitos patógenos relacionados, como Leishmania, "dijo Annika Wagner, autor principal del estudio publicado recientemente en Edición internacional Angewandte Chemie .
El inhibidor induce la dimerización de la proteína parásita esencial
El principio se basa en el hecho de que un pequeño, inhibidor selectivo se une a la enzima triparedoxina. Esta proteína es esencial para el parásito, protegiéndolo del daño oxidativo, pero no está presente en humanos, convirtiéndolo en un objetivo farmacológico viable. Para su sorpresa, el equipo de investigadores descubrió que cuando el inhibidor se une a la proteína, dos de los complejos inhibidor-proteína resultantes luego se combinan para formar un dímero estable. Cuando esto ocurre, la proteína normalmente monomérica deja de funcionar.
"Estábamos asombrados e inicialmente pensamos que era un efecto aleatorio debido a las condiciones experimentales, ", dijo Hellmich. La investigación se extendió luego, y se verificó en un estudio a gran escala utilizando varios métodos que el efecto de dimerización podía reproducirse. Además de los equipos de investigación de Mainz del profesor Ute Hellmich y el profesor Till Opatz, investigadores de las universidades de Frankfurt, Wurzburgo, Heidelberg, y el Laboratorio Europeo de Biología Molecular (EMBL) en Grenoble participaron.
La investigación altamente interdisciplinaria resulta exitosa
La dimerización que ha descubierto la investigación es inusual porque la molécula responsable es extremadamente pequeña. La mayoría de las moléculas que actúan como un adhesivo molecular para combinar monómeros individuales para formar un dímero son relativamente grandes. "Nuestra molécula es mucho más pequeña y puede reconocer directamente la proteína, ", explicó Hellmich. Las moléculas pequeñas también son más fáciles de pasar de contrabando a las células, que podría ser el punto de partida para nuevos conceptos de fármacos.
Al demostrar con precisión el mecanismo por el cual la proteína del parásito es inhibida químicamente y dimerizada por la molécula pequeña, la asociación de investigación interdisciplinaria ha señalado los fundamentos que subyacen a este nuevo concepto. "Fue crucial que no nos detuviéramos en nuestro objetivo original de simplemente determinar la estructura cristalina del complejo proteína-inhibidor, "dijo Hellmich." En cambio, Echamos un segundo vistazo al resultado y luego lo discutimos con expertos de diferentes campos. La investigación solo progresa cuando trabajamos juntos ".