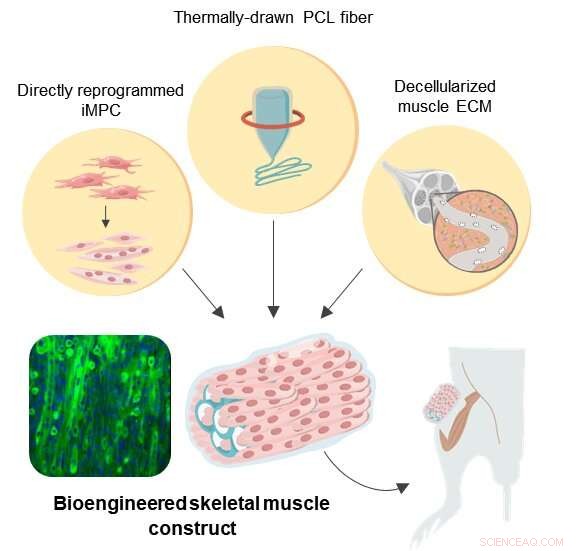
Ilustración esquemática de construcciones de bioingeniería similares a músculos esqueléticos en 3D Crédito:Instituto de Ciencias Básicas
El músculo constituye el órgano más grande de los seres humanos, representando el 40% de la masa corporal, y juega un papel esencial en el mantenimiento de la vida. El tejido muscular se destaca por su capacidad única de regeneración espontánea. Sin embargo, en lesiones graves como las sufridas en accidentes automovilísticos o la resección de un tumor que da como resultado una pérdida de músculo volumétrico (VML), la capacidad del músculo para recuperarse se ve muy disminuida. En la actualidad, Los tratamientos de VML comprenden intervenciones quirúrgicas con colgajos o injertos musculares autólogos acompañados de fisioterapia. Sin embargo, Los procedimientos quirúrgicos a menudo conducen a una función muscular reducida, y en algunos casos resulta en una falla completa del injerto. Por lo tanto, Existe una demanda de opciones terapéuticas adicionales para mejorar la recuperación de la pérdida muscular.
Una estrategia prometedora para mejorar la capacidad funcional del músculo dañado es inducir la regeneración de novo del músculo esquelético mediante la integración de células trasplantadas. Diversos tipos de células, incluidas las células satélite (células madre musculares), mioblastos, y células madre mesenquimales, se han utilizado para tratar la pérdida de masa muscular. Sin embargo, biopsias musculares invasivas, escasa disponibilidad de celdas, y el mantenimiento limitado a largo plazo impiden la traducción clínica, donde se pueden necesitar de millones a miles de millones de células maduras para proporcionar beneficios terapéuticos.
Otro tema importante es controlar el microambiente tridimensional en el sitio de la lesión para asegurar que las células trasplantadas se diferencien adecuadamente en tejidos musculares con estructuras deseables. Se ha utilizado una variedad de biomateriales naturales y sintéticos para mejorar la supervivencia y maduración de las células trasplantadas mientras se reclutan células huésped para la regeneración muscular. Sin embargo, hay sin resolver, dilemas duraderos en el desarrollo del andamio tisular. Los andamios naturales exhiben un alto reconocimiento celular y afinidad de unión celular, pero a menudo no proporcionan robustez mecánica en lesiones grandes o tejidos portadores de carga que requieren apoyo mecánico a largo plazo. A diferencia de, Los andamios sintéticos proporcionan una alternativa diseñada con precisión con propiedades físicas y mecánicas ajustables, así como estructuras y composiciones bioquímicas a medida, pero a menudo se ven obstaculizados por la falta de reclutamiento celular y la mala integración con el tejido del huésped.

Imagen SEM del andamio PCL poroso con MEM Crédito:Instituto de Ciencias Básicas
Para superar estos desafíos, un equipo de investigación del Centro de Nanomedicina del Instituto de Ciencias Básicas (IBS) de Seúl, Corea del Sur, Universidad de Yonsei, y el Instituto de Tecnología de Massachusetts (MIT) ideó un protocolo novedoso para la regeneración muscular artificial. El equipo logró un tratamiento eficaz de VML en un modelo de ratón mediante el empleo de tecnología de reprogramación celular directa en combinación con un andamio híbrido natural-sintético.
Reprogramación celular directa, también llamada conversión directa, es una estrategia eficaz que proporciona una terapia celular eficaz porque permite la generación rápida de células diana específicas del paciente utilizando células autólogas de la biopsia de tejido. Los fibroblastos son las células que se encuentran comúnmente dentro de los tejidos conectivos, y están muy involucrados en la cicatrización de heridas. Como los fibroblastos no son células diferenciadas terminalmente, es posible convertirlos en células progenitoras miogénicas inducidas (iMPC) utilizando varios factores de transcripción diferentes. Aquí en, esta estrategia se aplicó para proporcionar iMPC para la ingeniería de tejidos musculares.
Para proporcionar soporte estructural a las células musculares en proliferación, policaprolactona (PCL), fue elegido como material para la fabricación de un andamio poroso debido a su alta biocompatibilidad. Si bien la lixiviación de sal es un método ampliamente utilizado para crear materiales porosos, se limita principalmente a producir estructuras porosas cerradas. Para superar esta limitación, los investigadores ampliaron el método de lixiviación de sal convencional con estirado térmico para producir andamios de fibra PCL personalizados. Esta técnica facilitó la fabricación de alto rendimiento de fibras porosas con rigidez controlada, porosidad, y dimensiones que permiten una adaptación precisa de los andamios a los lugares de las lesiones.
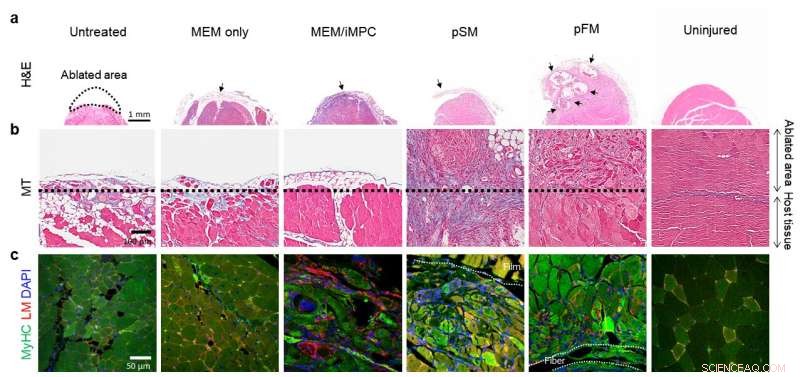
Recuperación del tejido muscular extirpado a) 1 semana y b-c) 4 semanas después del trasplante Crédito:Instituto de Ciencias Básicas
Sin embargo, los armazones de fibra sintética PCL por sí solos no proporcionan señales bioquímicas y mecánicas locales óptimas que imiten el microambiente específico del músculo. Por lo tanto, la construcción de un andamio híbrido se completó mediante la incorporación de hidrogel de matriz extracelular de músculo descelularizado (MEM) en la estructura de PCL. En la actualidad, MEM es uno de los biomateriales naturales más utilizados para el tratamiento de la VML en la práctica clínica. Por lo tanto, los investigadores creen que los andamios híbridos diseñados con MEM tienen un enorme potencial en aplicaciones clínicas.
Las construcciones de fibras musculares obtenidas mediante bioingeniería resultantes mostraron una rigidez mecánica similar a la de los tejidos musculares y exhibieron una diferenciación muscular mejorada y una alineación muscular alargada in vitro. Es más, implantation of bioengineered muscle constructs in the VML mouse model not only promoted muscle regeneration with increased innervation and angiogenesis but also facilitated the functional recovery of damaged muscles. The research team notes:"The hybrid muscle construct might have guided the responses of exogenously added reprogrammed muscle cells and infiltrating host cell populations to enhance functional muscle regeneration by orchestrating differentiation, paracrine effect, and constructive tissue remodeling."
Prof. Cho Seung-Woo from the IBS Center for Nanomedicine and Yonsei University College of Life Science and Biotechnology who led this study notes, "Further studies are required to elucidate the mechanisms of muscle regeneration by our hybrid constructs and to empower the clinical translation of cell-instructive delivery platforms."