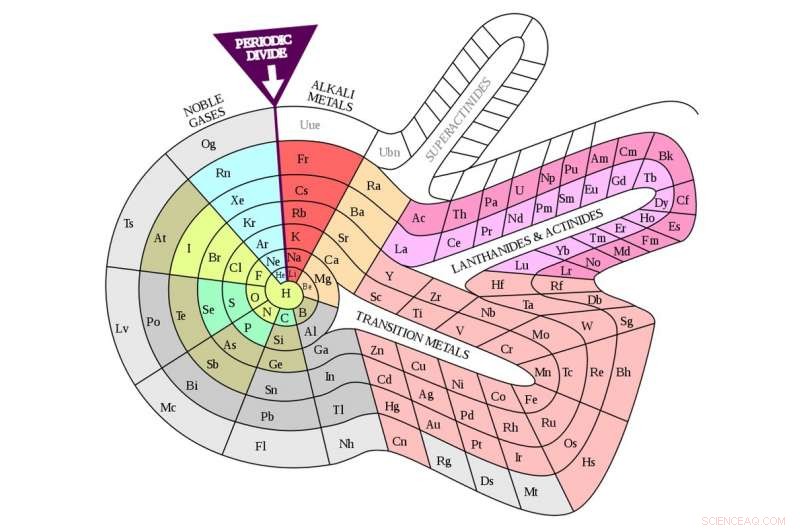
La mesa de espira de Theodor Benfey (1964). Crédito:DePiep / Wikipedia
La tabla periódica mira hacia abajo desde las paredes de casi todos los laboratorios de química. El mérito de su creación generalmente es para Dimitri Mendeleev, un químico ruso que en 1869 escribió los elementos conocidos (de los cuales había 63 en ese momento) en tarjetas y luego los ordenó en columnas y filas de acuerdo con sus propiedades químicas y físicas. Para celebrar el 150 aniversario de este momento crucial en la ciencia, la ONU ha proclamado 2019 como el año internacional de la tabla periódica.
Pero la tabla periódica en realidad no comenzó con Mendeleev. Muchos habían jugado con la organización de los elementos. Décadas antes, El químico John Dalton intentó crear una tabla, así como algunos símbolos bastante interesantes para los elementos (no se dieron cuenta). Y solo unos años antes de que Mendeleev se sentara con su baraja de cartas caseras, John Newlands también creó una tabla ordenando los elementos por sus propiedades.
El genio de Mendeleev estaba en lo que dejó fuera de su mesa. Reconoció que faltaban ciertos elementos, aún por descubrir. Entonces, ¿dónde Dalton, Newlands y otros habían expuesto lo que se sabía, Mendeleev dejó espacio para lo desconocido. Aún más asombroso, predijo con precisión las propiedades de los elementos faltantes.
¿Observa los signos de interrogación en su tabla de arriba? Por ejemplo, al lado de Al (aluminio) hay espacio para un metal desconocido. Mendeleev predijo que tendría una masa atómica de 68, una densidad de seis gramos por centímetro cúbico y un punto de fusión muy bajo. Seis años después Paul Émile Lecoq de Boisbaudran, galio aislado y, efectivamente, encajó en el hueco con una masa atómica de 69,7, una densidad de 5,9 g / cm³ y un punto de fusión tan bajo que se vuelve líquido en la mano. Mendeleev hizo lo mismo con el escandio, germanio y tecnecio (que no se descubrió hasta 1937, 30 años después de su muerte).

Lista de elementos de John Dalton. Crédito:Wikimedia Commons
A primera vista, la tabla de Mendeleev no se parece mucho a la que conocemos. Por una cosa, la mesa moderna tiene un montón de elementos que Mendeleev pasó por alto (y no dejó espacio para), más notablemente los gases nobles (como el helio, neón, argón). Y la mesa está orientada de manera diferente a nuestra versión moderna, con elementos que ahora colocamos juntos en columnas dispuestas en filas.
Pero una vez que le das a la mesa de Mendeleev un giro de 90 grados, la similitud con la versión moderna se hace evidente. Por ejemplo, los halógenos - flúor (F), cloro (Cl), bromo (Br), y yodo (I) (el símbolo J en la tabla de Mendeleev) - todos aparecen uno al lado del otro. Hoy están ordenados en la columna 17 de la tabla (o en el grupo 17 como prefieren llamarlo los químicos).

La mesa de Dimitry Mendeleev se completa con elementos faltantes. Crédito:Wikimedia Commons
Periodo de experimentación
Puede parecer un pequeño salto de esto al diagrama familiar, pero, años después de las publicaciones de Mendeleev, hubo mucha experimentación con diseños alternativos para los elementos. Incluso antes de que la mesa tuviera su giro permanente en ángulo recto, la gente sugirió algunos giros extraños y maravillosos.
Un ejemplo particularmente sorprendente es la espiral de Heinrich Baumhauer, publicado en 1870, con hidrógeno en su centro y elementos con masa atómica creciente en espiral hacia afuera. Los elementos que caen en cada uno de los radios de la rueda comparten propiedades comunes al igual que los de una columna (grupo) lo hacen en la tabla de hoy. También estaba la extraña formulación "tonta" de Henry Basset de 1892.
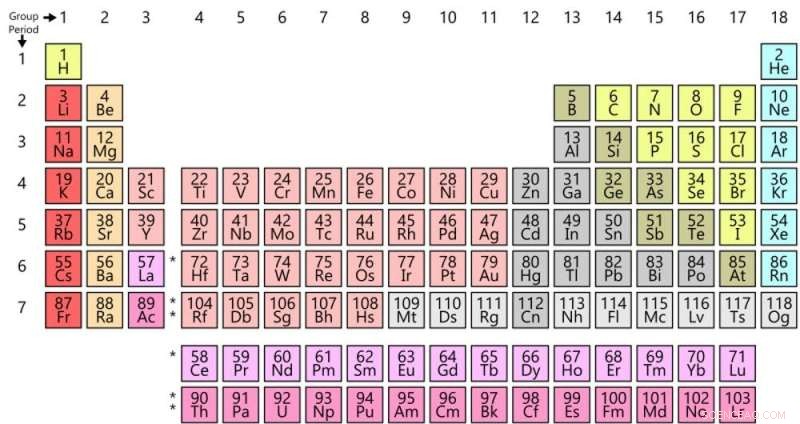
Tabla periódica de hoy. Crédito:Offnfopt / Wikipedia
Sin embargo, a principios del siglo XX, la mesa se había asentado en un formato horizontal familiar con la versión sorprendentemente moderna de Heinrich Werner en 1905. Por primera vez, los gases nobles aparecieron en su posición ahora familiar en el extremo derecho de la mesa. Werner también trató de sacar una hoja del libro de Mendeleev dejando espacios, aunque exageró las conjeturas con sugerencias de elementos más ligeros que el hidrógeno y otro que se encuentra entre el hidrógeno y el helio (ninguno de los cuales existe).
A pesar de esta mesa de aspecto bastante moderno, todavía quedaba un poco por hacer. Particularmente influyente fue la versión de Charles Janet. Tomó el enfoque de un físico para la mesa y utilizó una teoría cuántica recién descubierta para crear un diseño basado en configuraciones electrónicas. Muchos físicos todavía prefieren la tabla del "paso izquierdo" resultante. Curiosamente, Janet también proporcionó espacio para elementos hasta el número 120 a pesar de que solo se conocían 92 en ese momento (solo estamos en 118 ahora).

Espiral de Heinrich Baumhauer. Reimpreso (adaptado) con permiso de Tipos de clasificaciones gráficas de los elementos. III. Espiral, helicoidal, y cartas misceláneas. Crédito:G. N. Quam, Mary Battell Quam. Copyright (1934) Sociedad Química Estadounidense.
Decidirse por un diseño
La mesa moderna es en realidad una evolución directa de la versión de Janet. Los metales alcalinos (el grupo coronado por litio) y los metales alcalinotérreos (coronados por berilio) se desplazaron desde el extremo derecho al extremo izquierdo para crear una tabla periódica de aspecto muy amplio (forma larga). El problema con este formato es que no encaja bien en una página o póster, por lo tanto, en gran parte por razones estéticas, los elementos del bloque f generalmente se cortan y se depositan debajo de la mesa principal. Así llegamos a la mesa que hoy reconocemos.
Eso no quiere decir que la gente no haya modificado los diseños, a menudo como un intento de resaltar las correlaciones entre elementos que no son evidentes en la tabla convencional. Hay literalmente cientos de variaciones (consulte la base de datos de Mark Leach) con espirales y versiones en 3D que son particularmente populares. sin mencionar más variantes irónicas.
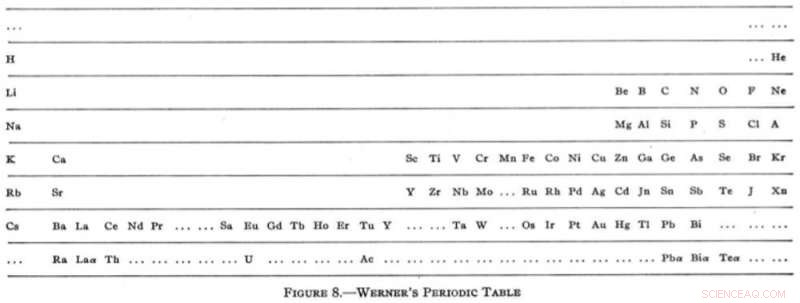
La encarnación moderna de Heinrich Werner. Reimpreso (adaptado) con permiso de Tipos de clasificaciones gráficas de los elementos. I. Introducción y tablas breves, G. N. Quam, Mary Battell Quam. Crédito:Sociedad Química Estadounidense (1934)
¿Qué tal mi propia fusión de dos gráficos icónicos? ¿La mesa de Mendeleev y el mapa del metro de Londres de Henry Beck a continuación?
O la vertiginosa variedad de imitaciones que tienen como objetivo dar un toque científico a la categorización de todo, desde la cerveza hasta los personajes de Disney, y mi particular "tontería irracional" favorita. Todo lo cual demuestra cómo la tabla periódica de elementos se ha convertido en el símbolo icónico de la ciencia.

La mesa del escalón izquierdo de Charles Janet. Crédito:Wikipedia, CC BY-SA

Versión 3D de la mesa con "flor de Mendeleiev". Crédito:Тимохова Ольга / Wikipedia, CC BY-SA
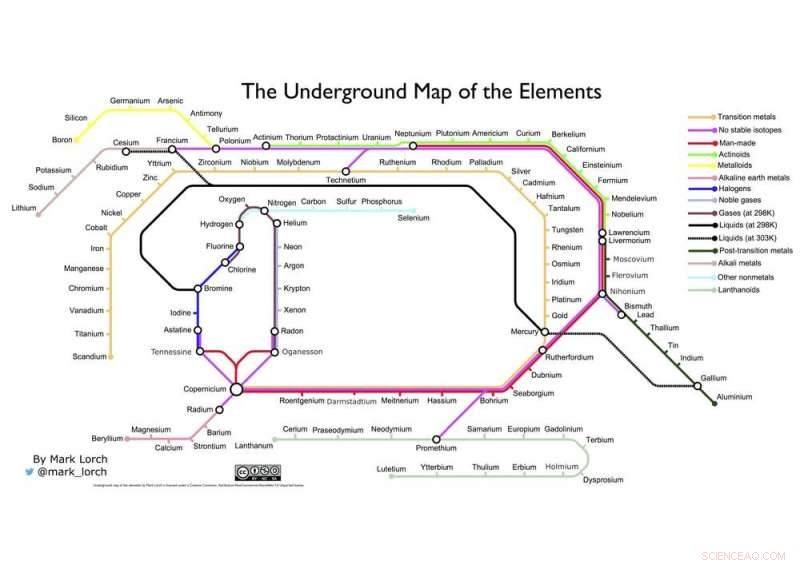
El mapa subterráneo de los elementos del autor. Crédito:Mark Lorch, Autor proporcionado
Este artículo se ha vuelto a publicar de The Conversation con una licencia de Creative Commons. Lea el artículo original. 